国内第Ⅰ/Ⅱ相臨床試験(FDS-J02試験)1,2)
再発・難治性PTCL患者におけるムンデシン®
試験デザイン
試験概要
多施設共同、非盲検、単群、非無作為化試験
目的
[第Ⅰ相]
ムンデシン®300mgを1日2回(600mg/日)28日間連日経口投与した際の再発・難治性PTCL患者における安全性及び忍容性を確認し、推奨用法・用量を決定する。
[第Ⅱ相]
第Ⅰ相部分で決定された推奨用法・用量における有効性、安全性、及び薬物動態を評価する。
対象
再発・難治性PTCL患者48例
(安全性解析対象例数:第Ⅰ相4例+第Ⅱ相44例 有効性解析対象例数:第Ⅱ相41例)
用法・用量
ムンデシン®300mg(フォロデシン100mg含有カプセル×3カプセル)を1日2回、食後に経口投与した。
投与期間・投与方法
ムンデシン®投与開始からムンデシン®投与中止基準※¹に該当するまで(第Ⅰ相:28日間、第Ⅱ相:24週間[データカットオフ 2015年8月3日])。
第Ⅰ相、第Ⅱ相のいずれもスクリーニング期間(最大14日間)、投与期間、安全性フォローアップ期間(ムンデシン®の最終投与日から30日間)を設けて実施した。
評価項目
[主要評価項目]
第Ⅱ相部分における画像評価委員会の評価に基づく客観的奏効割合(ORR)
[副次評価項目]
全生存期間(OS)、無増悪生存期間(PFS)、投与持続期間(TTF)、奏効期間(DoR)、奏効到達時間(TTR)、標的病変の最大縮小率、標的病変の縮小率、背景因子によるORRの層別解析など
[その他の評価項目]
安全性:副作用、臨床検査(血液学的検査、生化学検査及び尿検査)、薬物動態、薬力学など
解析計画
ORRは、有効性解析対象全例のうち最良総合効果がCR又はPRと評価された患者の割合とした。最良総合効果は規定の効果判定規準※²を用いて調査期間中に記録された最良の効果とした。OS、PFS、TTF、DoR、TTRについては、Kaplan-Meier法によりTime-to-event解析を行った。主要、副次評価項目は共にORRが閾値奏効割合(10%)以下であるか否かを有意水準(片側)5%にて検定した。また、背景因子によるORRの層別解析(サブグループ解析)を行うこととした。
※1 投与中止基準:次の項目に該当した場合、ムンデシン®投与を中止し、安全性フォローアップ期間へと移行・ 次治療を必要とする増悪が認められた場合・T細胞リンパ腫に対する新たな治療を開始する場合・用量制限毒性(DLT)が発現した場合・ムンデシン®の休薬に該当する有害事象によりムンデシン®の投与を再開できない場合・忍容不能な有害事象が発現した場合・投与期間中に併用禁止の薬剤を使用又は非薬物療法を実施した場合・患者が妊娠した場合・患者が同意を撤回した場合・治験責任/分担医師が患者の試験継続が不適切と判断した場合
※2 最良総合効果は、規定のリンパ腫
有効性
(1) 画像評価委員会の評価に基づく客観的奏効割合(ORR)[主要評価項目]
第Ⅱ相部分の有効性の最大の解析対象集団(FAS)41例の主解析におけるORRは、22%(9/41例)(90%信頼区間:12~35)であり、二項検定により帰無仮説(ORR≦10%)が棄却され、本剤の真のORRが閾値奏効割合(10%)を有意に上回ることが示されました(p=0.018、有意水準片側5%)。
最終解析ではSDであった1例の評価がPRとなり、ORRは25%(10/41例)(90%信頼区間:14〜38)となりました。
●画像評価委員会の評価に基づくORR
| 抗腫瘍効果 | 第Ⅱ相:主要評価項目 (n=41) | 第Ⅰ相+第Ⅱ相 (n=45) |
|---|---|---|
| 主解析 | ||
| DCR(CR+PR+SD) | 16例(39%) | 17例(38%) |
| ORR(CR+PR) 90%信頼区間 | 9例(22%) 12~35* | 10例(22%) 13~35 |
| CR | 4例(10%) | 4例(9%) |
| PR | 5例(12%) | 6例(13%) |
| SD | 7例(17%) | 7例(16%) |
| PD/RD | 24例(59%) | 26例(58%) |
| 評価不能 | 1例(2%) | 2例(4%) |
| 最終解析 | ||
| DCR(CR+PR+SD) | 16例(39%) | 17例(38%) |
| ORR(CR+PR) 90%信頼区間 | 10例(25%) 14~38* | 11例(24%) 14~37 |
| CR | 4例(10%) | 4例(9%) |
| PR | 6例(15%) | 7例(16%) |
| SD | 6例(15%) | 6例(13%) |
| PD/RD | 24例(59%) | 26例(58%) |
| 評価不能 | 1例(2%) | 2例(4%) |
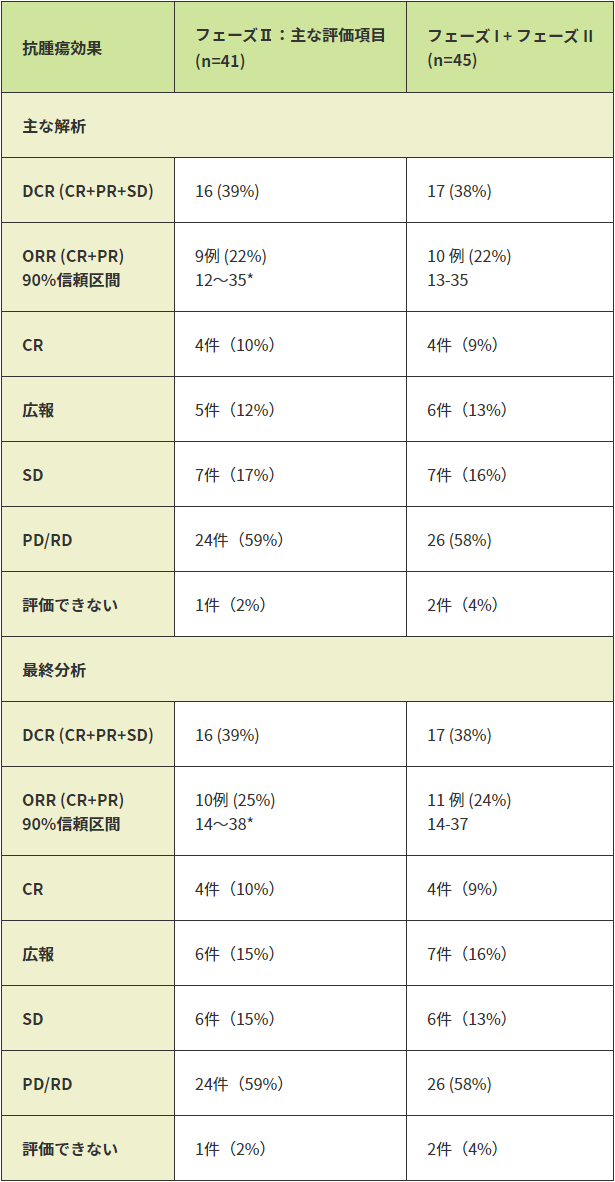
*一様最小分散不偏推定量(UMVUE)
全ての患者が試験開始から24週まで試験を完了した時点をデータカットオフとして主解析を実施し、その後、試験の全期間のデータで最終解析を実施しました。以降のページに掲載の有効性データは最終解析のデータとしました。
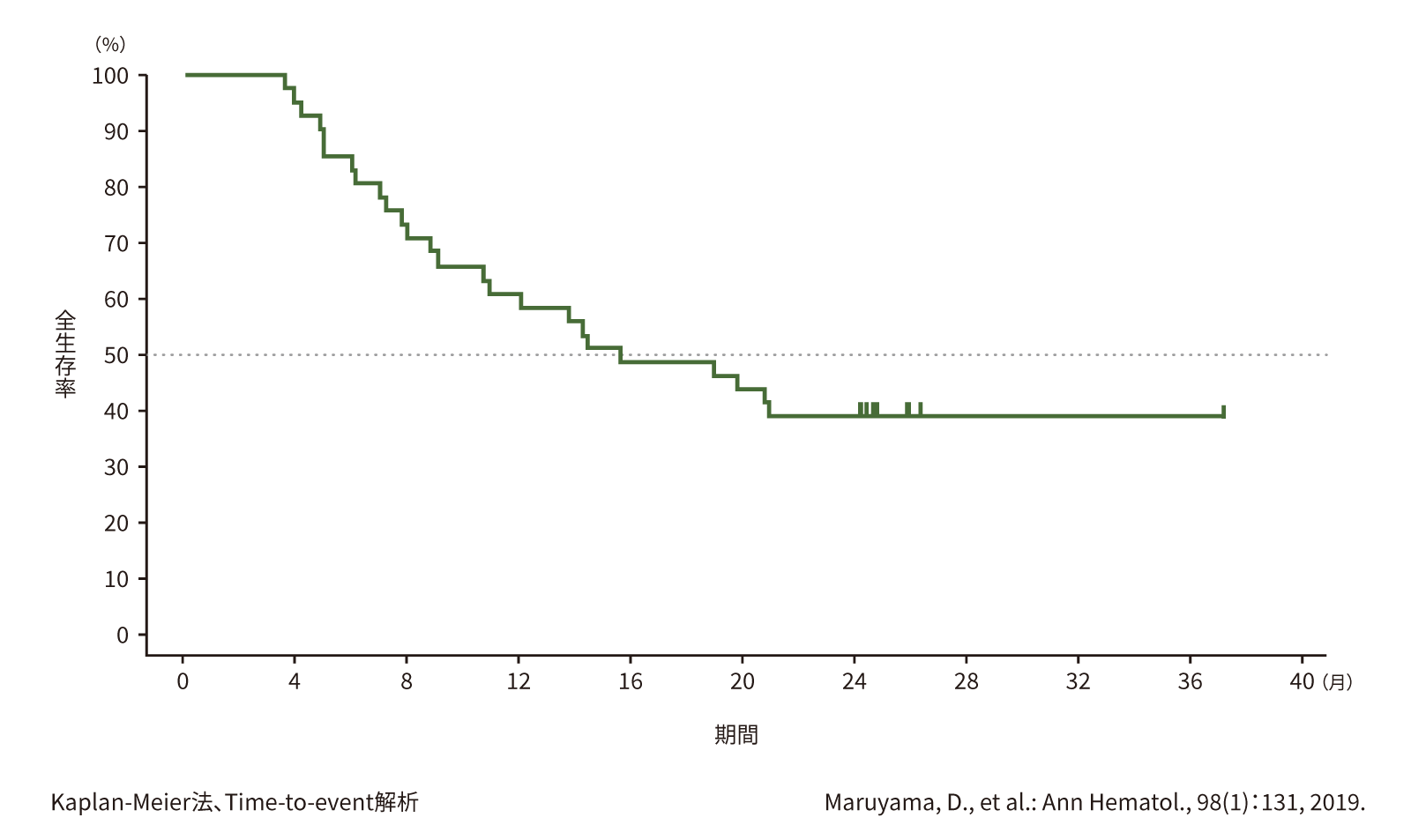
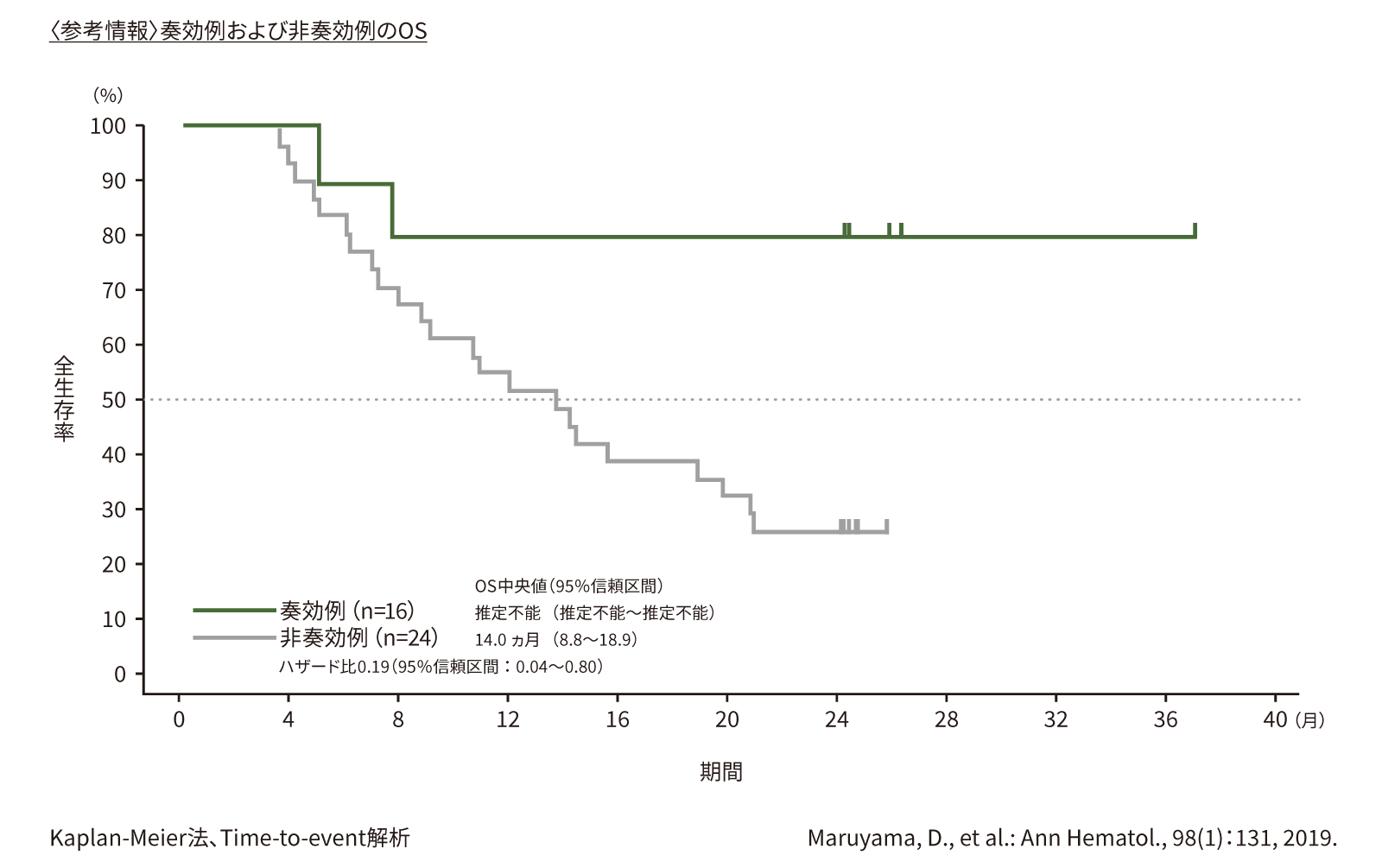
(2) 全生存期間(OS)[副次評価項目]
第Ⅱ相部分の有効性のFAS41例における最終解析時のOSの中央値は、15.6ヵ月(95%信頼区間:10.7ヵ月〜推定不能)で、2年OS率は39%でした。
●OS(第Ⅱ相)(n=41)
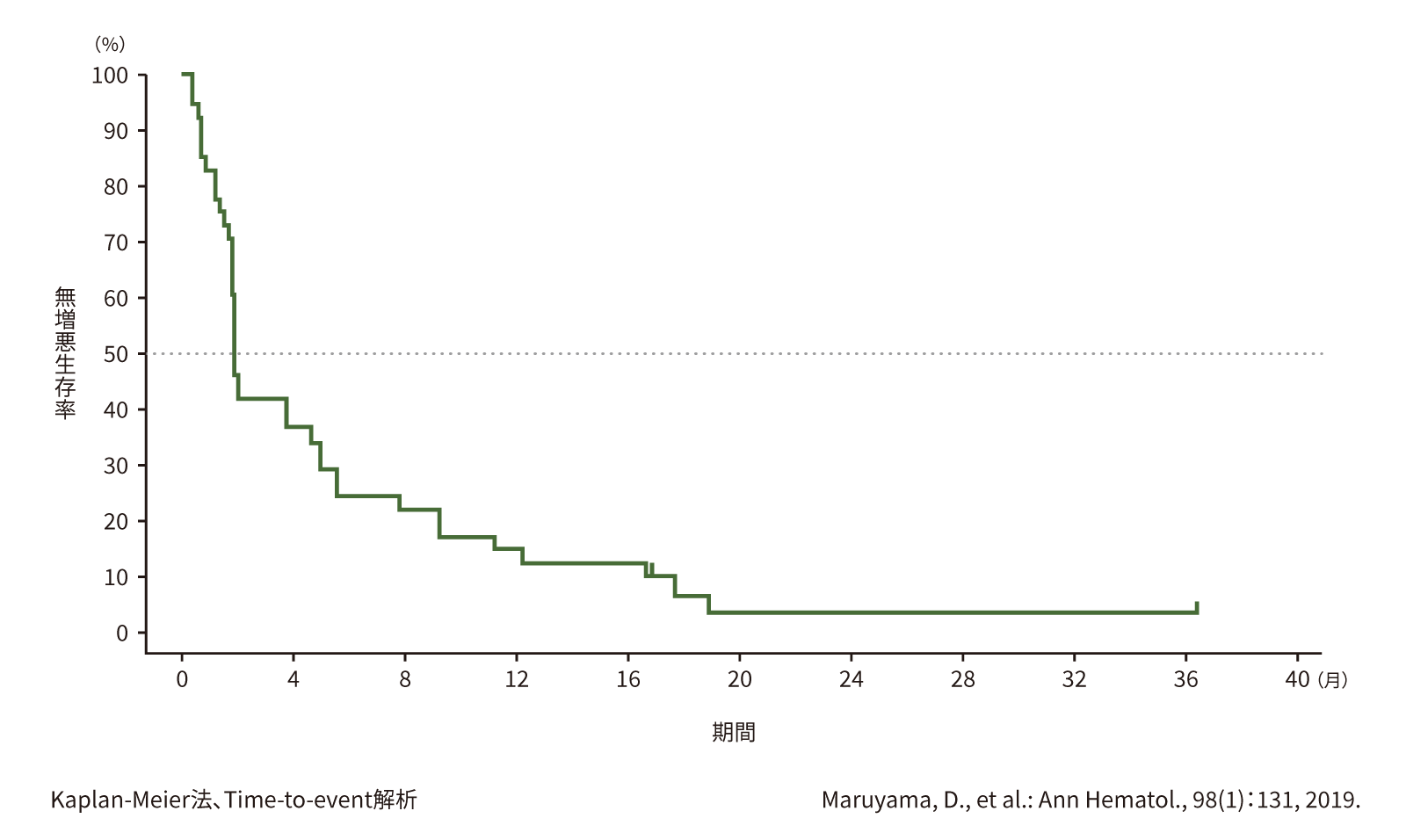
(3) 無増悪生存期間(PFS)[副次評価項目]
第Ⅱ相部分の有効性のFAS41例における最終解析時のPFSの中央値は、1.9ヵ月(95%信頼区間:1.8~4.6ヵ月)でした。
●PFS(第Ⅱ相)(n=41)
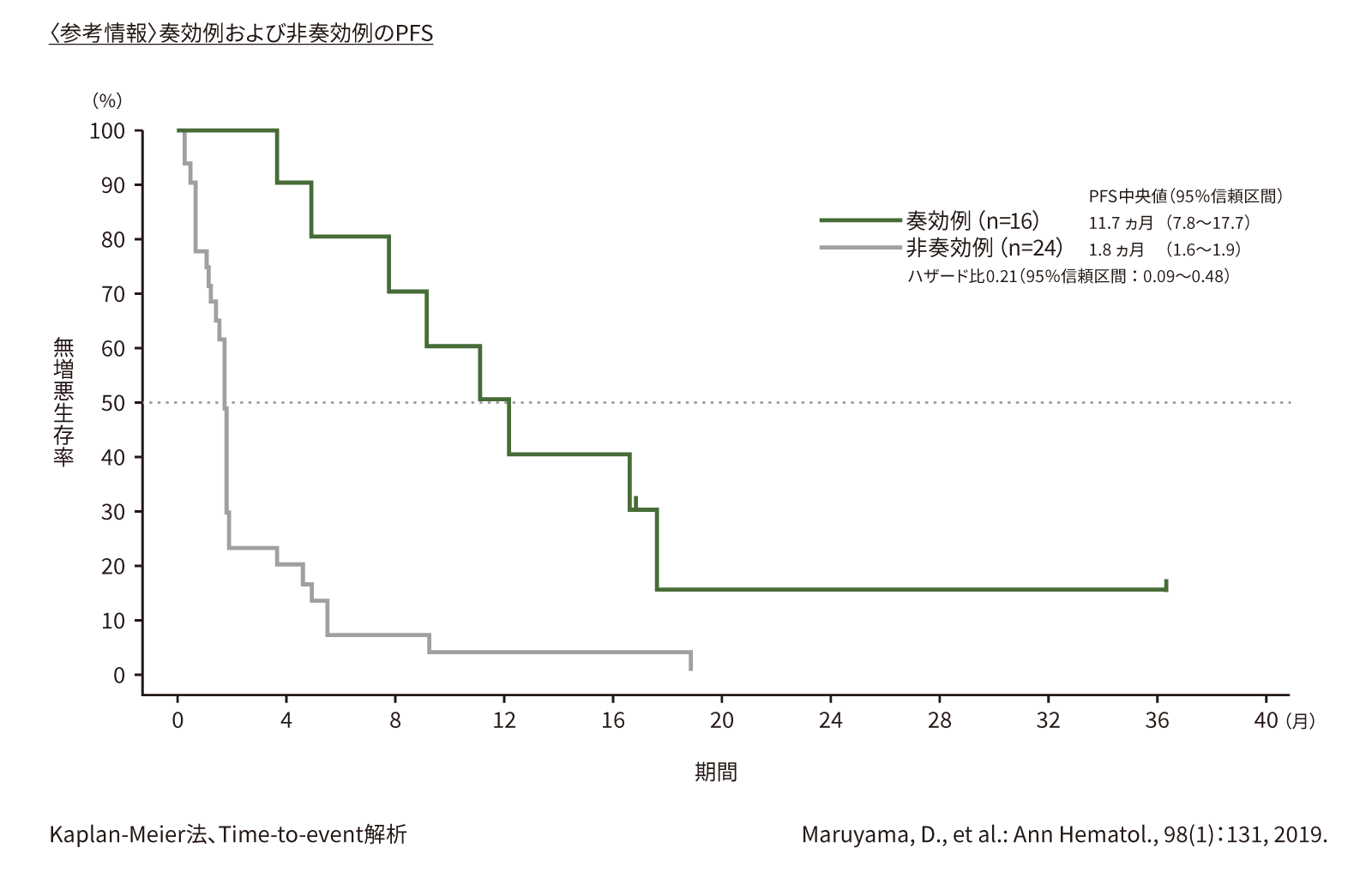
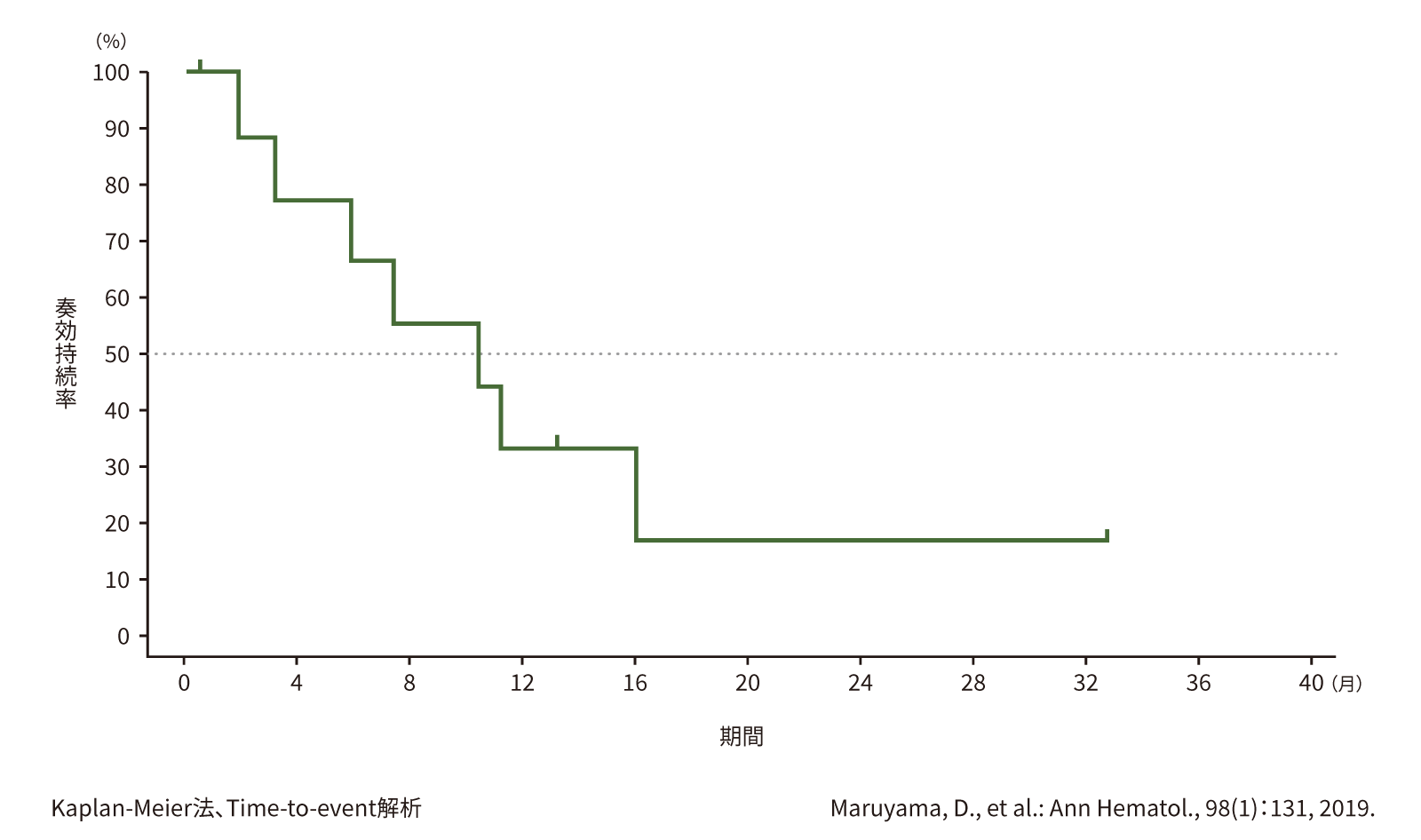
(4) 奏効期間(DoR)[副次評価項目]
第Ⅱ相部分で奏効が得られた10例のDoRの中央値は、10.4ヵ月(95%信頼区間:5.9〜16.0ヵ月)でした。
●DoR(第Ⅱ相)(n=10)
(5) 奏効到達時間[副次評価項目]
第Ⅱ相部分で奏効が得られた10例の奏効到達時間の中央値は、2.8ヵ月(範囲:1.8〜12.8ヵ月)でした。
(6) 画像評価委員会の評価に基づく標的病変の最大縮小率[副次評価項目]
第Ⅱ相部分の標的病変の最大縮小率のWaterfall plotより、変化率が0%以上の割合は33.3%(12/36例)、0%未満の割合は66.7%(24/36例)でした。
●標的病変の最大縮小率のWaterfall plot(第Ⅱ相)(n=36)
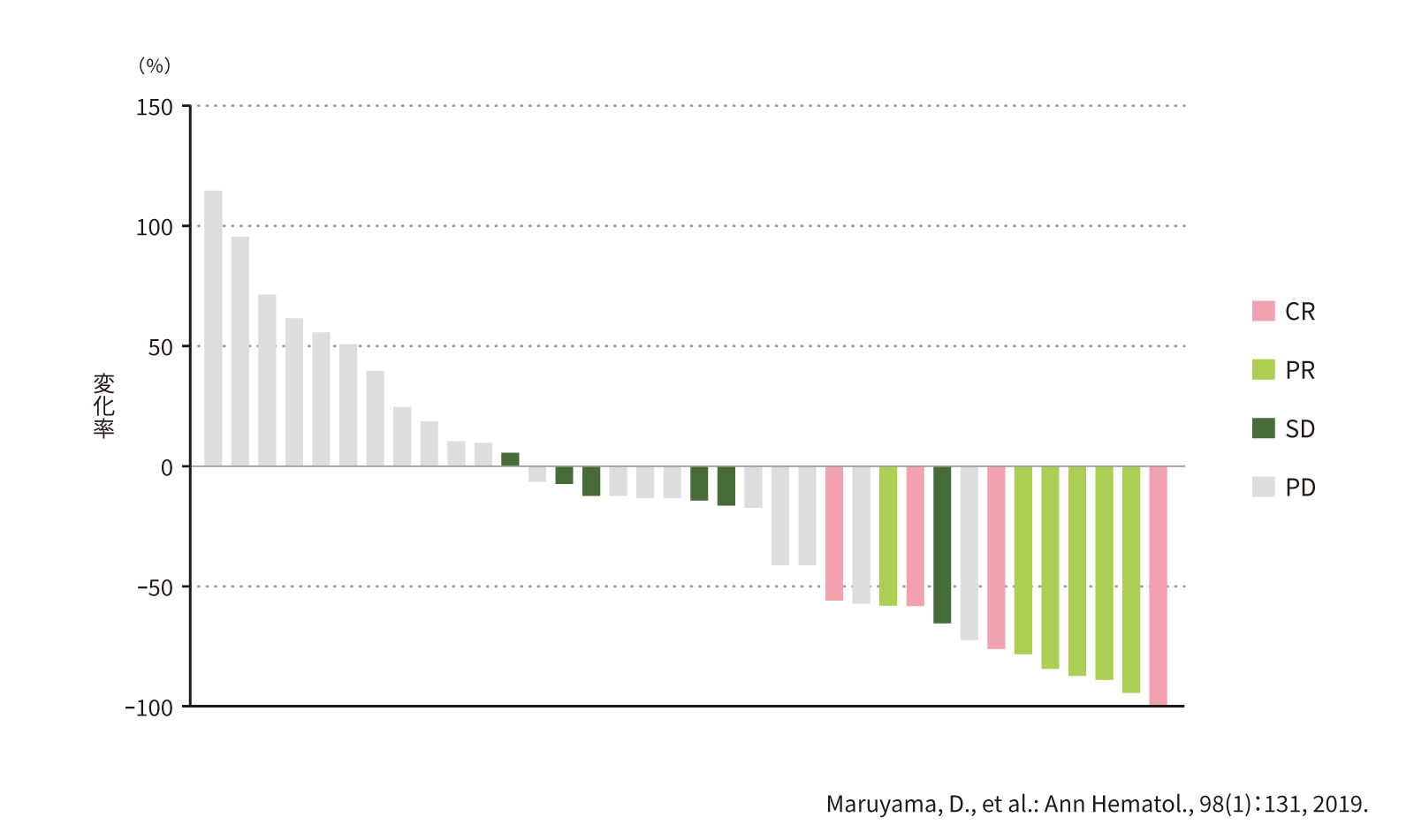
・CR~PDは最良総合効果(画像評価委員会による評価結果に基づく)
・FAS41例のうち、ムンデシン®投与開始後の画像が得られなかった5例を除く36例を対象とした。
(7) 画像評価委員会の評価に基づく標的病変の縮小率の推移[副次評価項目]
第Ⅱ相部分の標的病変の縮小率を時期別に算出し、ムンデシン®投与開始時をベースラインとした縮小率と画像評価委員会による最良総合効果(CR、PR、SD、PD)との関係を示すSpider plotより、CR及びPRが得られた患者では投与開始後100~300日を経て病変が徐々に縮小する傾向がみられました。
●標的病変縮小率の推移(第Ⅱ相)(n=36)
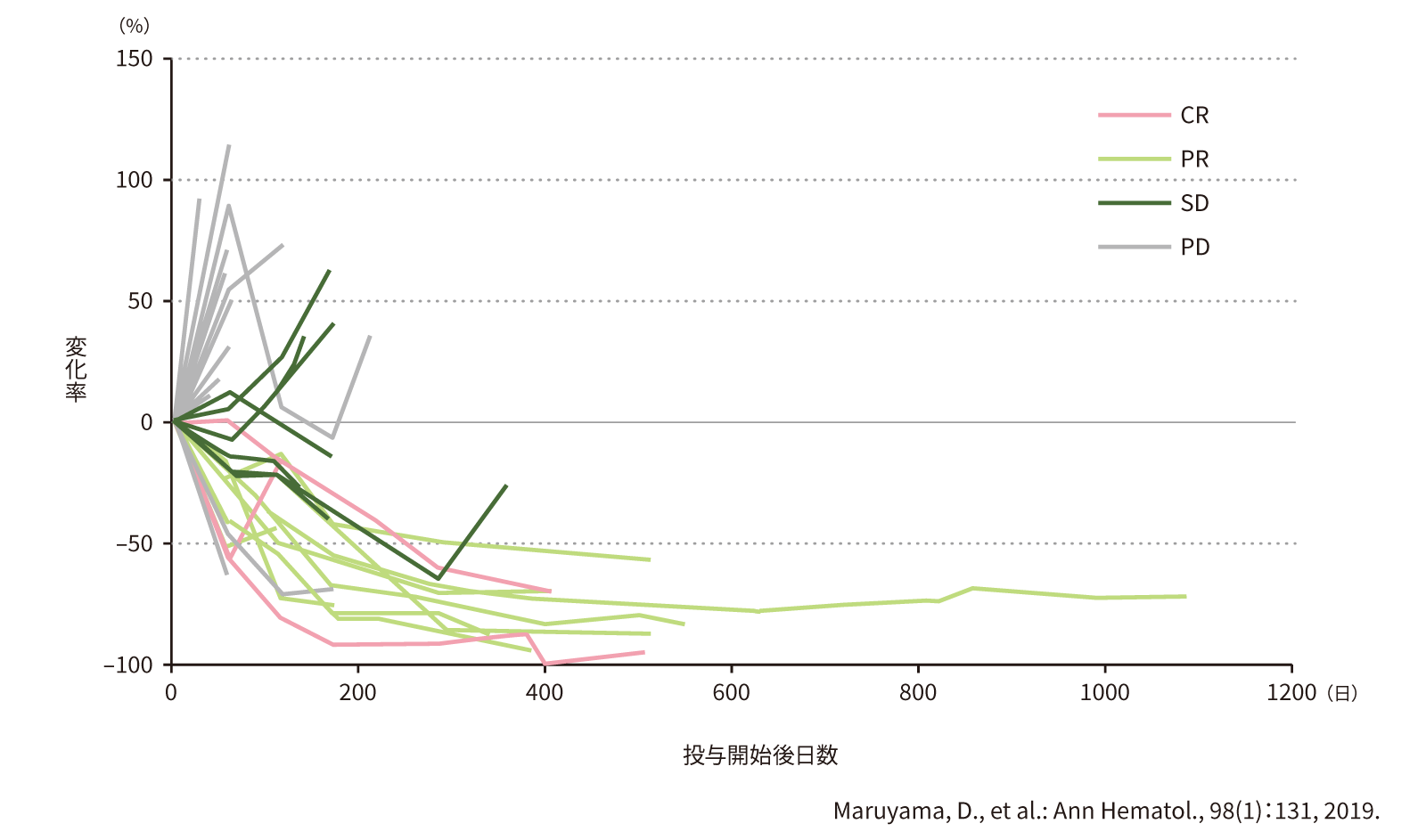
・CR~PDは最良総合効果(画像評価委員会による評価結果に基づく)
・FAS41例のうち、ムンデシン®投与開始後の画像が得られなかった5例を除く36例を対象とした。
安全性(最終解析時)
本試験全体(安全性解析対象集団)の副作用は、第Ⅰ相部分及び第Ⅱ相部分ともに全例(第Ⅰ相部分:4例[100%]、第Ⅱ相部分:44例[100%])に発現しました。
第Ⅰ/Ⅱ相で主な有害事象は、リンパ球減少が48例(100%)、白血球減少が35例(73%)、好中球減少が27例(56%)、血小板減少が23例(48%)、貧血が23例(48%)でした。
死亡は、第Ⅱ相部分の1例で、基礎疾患に起因し、本剤に関連しないと考えられる播種性血管内凝固及び多臓器不全で死亡しました。
投与中止に至った有害事象は、第Ⅰ/Ⅱ相部分で11例(23%)に発現し、その主なもの(2例以上)はエプスタイン・バーウイルス(EBV)関連悪性リンパ腫2例でした。
重篤な有害事象は第Ⅰ/Ⅱ相部分で22例(46%)に発現し、その主なもの(2例以上)は感染症8例、肺炎4例でした。 事象名はMedDRA/J ver.18.1に基づき分類しました。