国内第Ⅱ相臨床試験(PDX-LV試験)34)
再発又は難治性のPTCL患者を対象としたジフォルタ®とホリナートカルシウム併用の第Ⅱ相臨床試験
34)社内資料:再発・難治性末梢性T細胞リンパ腫患者を対象としたプララトレキサートとロイコボリン併用の第Ⅱ相臨床試験,PDX-LV試験(添付文書改訂時評価資料)
試験概要
試験デザイン
非盲検、単群、多施設共同
目的
再発又は難治性PTCL患者にジフォルタ®とホリナートカルシウムを併用投与し、ジフォルタ®に起因する口内炎に対するホリナートカルシウムの予防/軽減効果を検討する。
対象
再発又は難治性PTCL患者 13例
[計画時] 13例
[解析時] 安全性解析対象 13例、有効性解析対象 13例
用法・用量
基礎治療薬であるジフォルタ®の投与24時間後から、治験薬のホリナートカルシウム1回25mg又は15mgを8時間ごとに6回経口投与した。
投与期間
ジフォルタ®投与開始から7週間
評価項目
[主要評価項目]
第1サイクル中に発現したGrade 2以上の口内炎の発現率
口内炎の重症度は、治験責任/分担医師がNCI-CTCAE ver 3.0を用いて評価した。
[副次評価項目]
第1サイクル中に発現したGrade 3以上の口内炎の発現率、第1サイクル中に発現した全Gradeの口内炎の発現率、第1サイクル中に発現したGrade 2以上の口内炎の発現期間及び初回発現までの期間、治験責任/分担医師のCT画像評価又はPET-CT画像評価に基づくジフォルタⓇの客観的奏効割合(ORR)
[その他の評価項目]
安全性
解析計画
第1サイクル中に発現したGrade 2以上の口内炎の発現率について正確な二項分布に基づく点推定値及び片側95%信頼係数の信頼区間を算出し、算出した信頼区間の上限(両側90%信頼区間の上限と同等)が閾値(50%)を超えないことを示すこととした。
臨床成績
選択基準・除外基準
国内第Ⅱ相臨床試験(PDX-LV試験)
| 主な選択基準 |
■20歳以上の患者 ■病理組織学的にPTCLと診断され、かつ1レジメン以上の前治療歴を有する再発又は難治性患者 など |
|---|---|
| 主な除外基準 |
■ジフォルタ®投与開始前21日以内にPTCLに対する抗悪性腫瘍治療(化学療法、分子標的薬、生物学的製剤、免疫療法、放射線療法等)を受けた患者。又は、前治療の毒性から回復せず、臨床的に不安定である患者 ■口内炎を有する患者 など |
試験デザイン
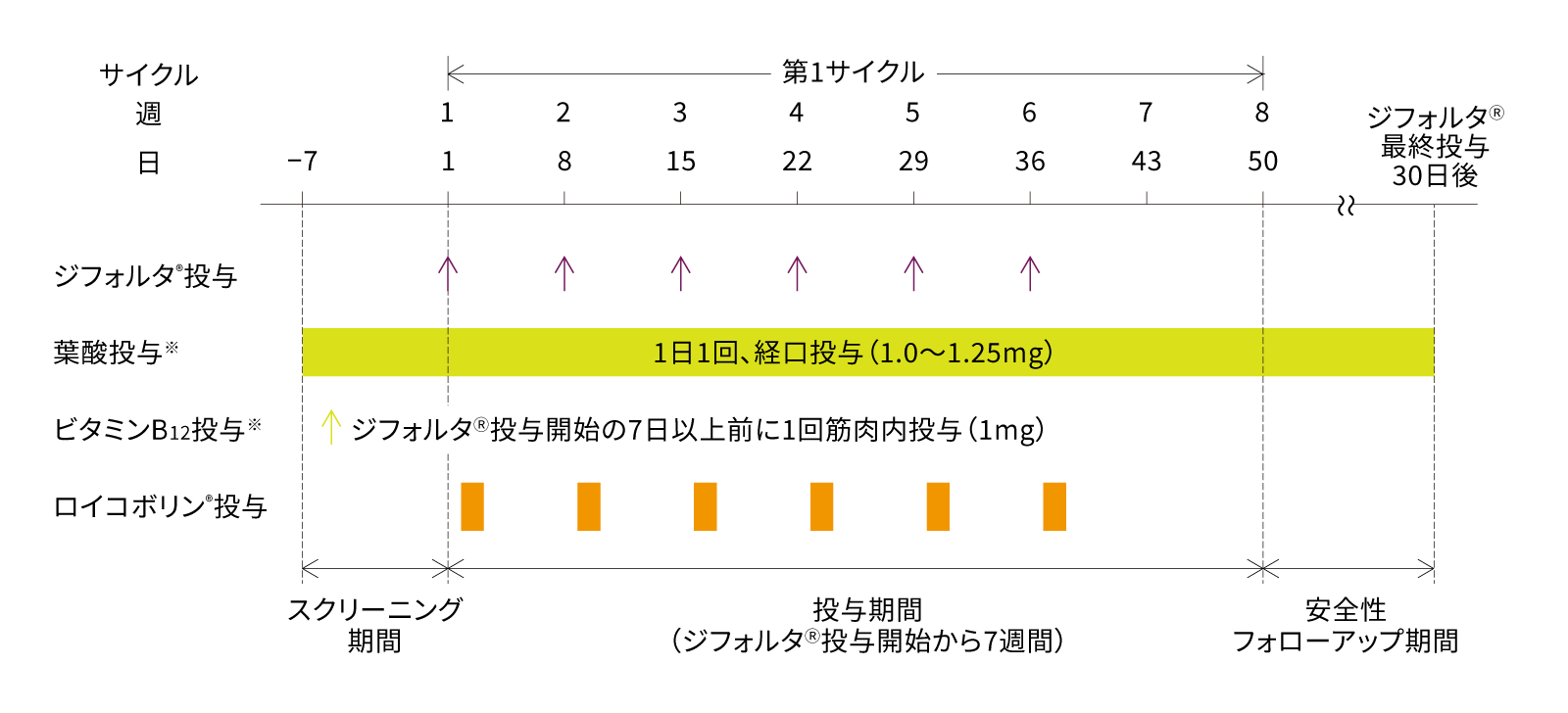
※ビタミン補充投与
ジフォルタ®投与開始の7日以上前から以下のビタミン補充投与を開始した。
葉酸:葉酸1.0~1.25mgをジフォルタ®投与開始の7日以上前から1日1回経口投与した。ジフォルタ®の最終投与後30日間は投与を継続した。
ビタミンB12:ビタミンB12 1mgをジフォルタ®投与開始の7日以上前に1回筋肉内投与した。
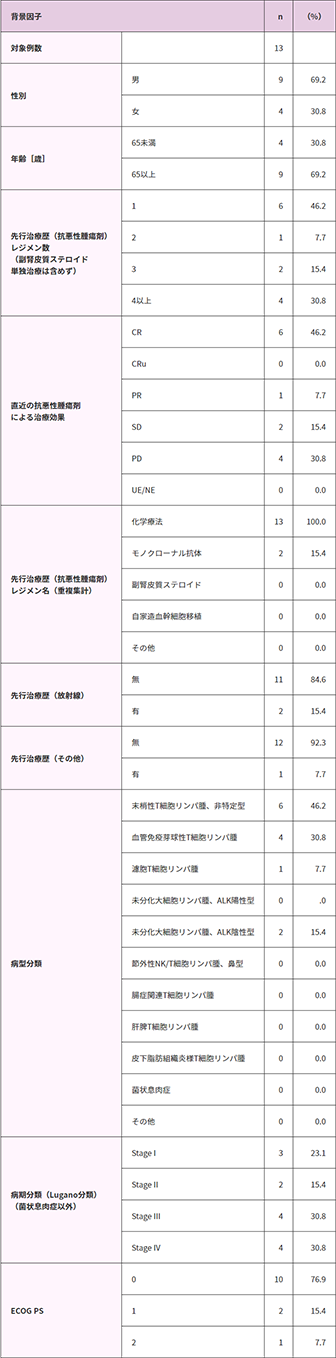
患者背景(安全性評価対象集団)
有効性
(1)第1サイクル中に発現したGrade 2以上の口内炎の発現率[主要評価項目]
第1サイクル中に発現したGrade 2以上の口内炎の発現率は7.7%(1/13例、90%信頼区間:0.4~31.6) でした。発現率の90%信頼区間の上限値が、閾値発現率である50%を下回りました。
| 対象例数 | 口内炎のGrade | 口内炎の発現率(%) | 発現例数 |
|---|---|---|---|
| 13 | Grade 2以上 | 7.7 | 1 |
| 対象例数 | 13 |
|---|---|
| 口内炎のGrade | Grade 2以上 |
| 口内炎の発現率(%) | 7.7 |
| 発現例数 | 1 |
[閾値設定の基準]
国内第Ⅰ/Ⅱ相試験における第1サイクル中のGrade 2以上の口内炎発現率(48.0%)に基づき設定
(2)第1サイクル中に発現したGrade 3以上の口内炎の発現率[副次評価項目]
第1サイクル中にGrade 3以上の口内炎は発現しませんでした。
| 対象例数 | 口内炎のGrade | 口内炎の発現率(%) | 発現例数 |
|---|---|---|---|
| 13 | Grade 3以上 | 0 | 0 |
| 対象例数 | 13 |
|---|---|
| 口内炎のGrade | Grade 3以上 |
| 口内炎の発現率(%) | 0 |
| 発現例数 | 0 |
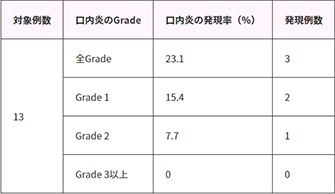
(3)第1サイクル中に発現した全Gradeの口内炎の発現率[副次評価項目]
第1サイクル中に発現した全Gradeの口内炎の発現率は、23.1%(3/13例、95%信頼区間:5.0~53.8)であり、重症度別の発現例数はGrade 1が2例、Grade 2が1例でした。
(4)第1サイクル中に発現したGrade 2以上の口内炎の発現期間及び初回発現までの期間[副次評価項目]
第1サイクル中にGrade 2以上の口内炎が1例に発現し、最悪重症度はGrade 2であった。Grade 2以上の口内炎の累計発現期間(同一症例におけるGrade 2以上の口内炎の発現期間の累計)、最長発現期間(同一症例におけるGrade 2以上の口内炎の発現期間の最大値)はともに2.0日、ジフォルタ®投与開始からGrade 2以上の口内炎の初回発現までの期間は10.0日でした。
| 対象例数 | 口内炎の Grade |
口内炎の 発現率(%) |
口内炎の 累計発現 期間(日) |
最長発現期間 (日) |
口内炎の初回 発現までの 期間(日) |
発現例数 |
|---|---|---|---|---|---|---|
| 13 | Grade 2以上 | 7.7 | 2.0 | 2.0 | 10.0 | 1 |
| 対象例数 | 13 |
|---|---|
| 口内炎の Grade | Grade 2以上 |
| 口内炎の 発現率(%) | 7.7 |
| 口内炎の累計 発現期間(日) |
2.0 |
| 最長発現期間 (日) |
2.0 |
| 口内炎の初回 発現までの期間(日) |
10.0 |
| 発現例数 | 1 |
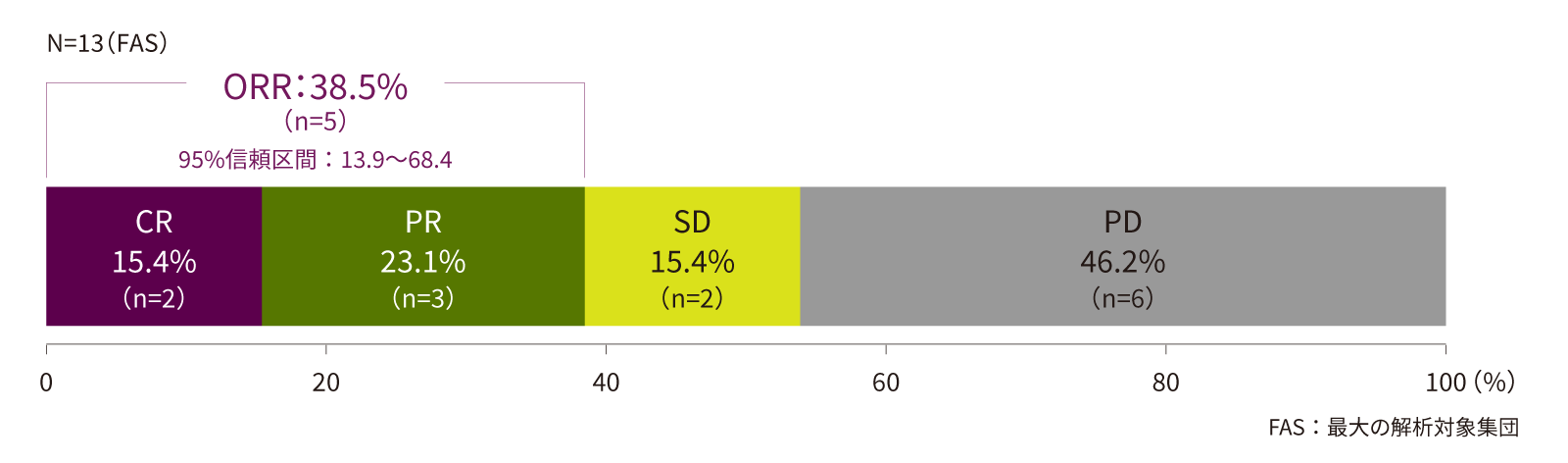
(5)治験責任/分担医師のCT画像評価又はPET-CT画像評価に基づくジフォルタ®のORR[副次評価項目]
画像評価に基づくジフォルタ®のORRは、38.5%(5/13例、95%信頼区間:13.9~68.4)でした。
安全性
安全性解析対象例のうち、ホリナートカルシウムによる副作用は認められませんでした。また、ジフォルタ®による副作用は84.6%(11/13例)に認められました。主な副作用(発現頻度30%以上)は、器官別大分類では臨床検査が46.2%(6/13例)と最も多く、リンパ球数減少46.2%(6/13例)及び白血球数減少30.8%(4/13例)でした。このうちGrade 3以上の副作用は、リンパ球減少症15.4%(2/13例)、リンパ球 数減少46.2%(6/13例)、好中球数減少7.7%(1/13例)、血小板数減少7.7%(1/13例)及び白血球数減少7.7%(1/13例)でした。
重篤な有害事象は7.7%(1/13例)に発現し、好中球減少症が1例認められました。ホリナートカルシウムの投与中止に至った有害事象及び投与中断に至った有害事象はありませんでした。ジフォルタ®の投与中止に至った有害事象はありませんでしたが、投与中断に至った有害事象は23.1%(3/13例)に発現し、帯状疱疹(1例)、好中球減少症(1例)、血小板減少症(1例)が認められました。
本試験において死亡例は1例認められましたが、有害事象による死亡ではなく、ホリナートカルシウム又はジフォルタ®との因果関係は否定されました。












