薬物動態

1.血漿中濃度
(1)単回静脈内急速投与1)
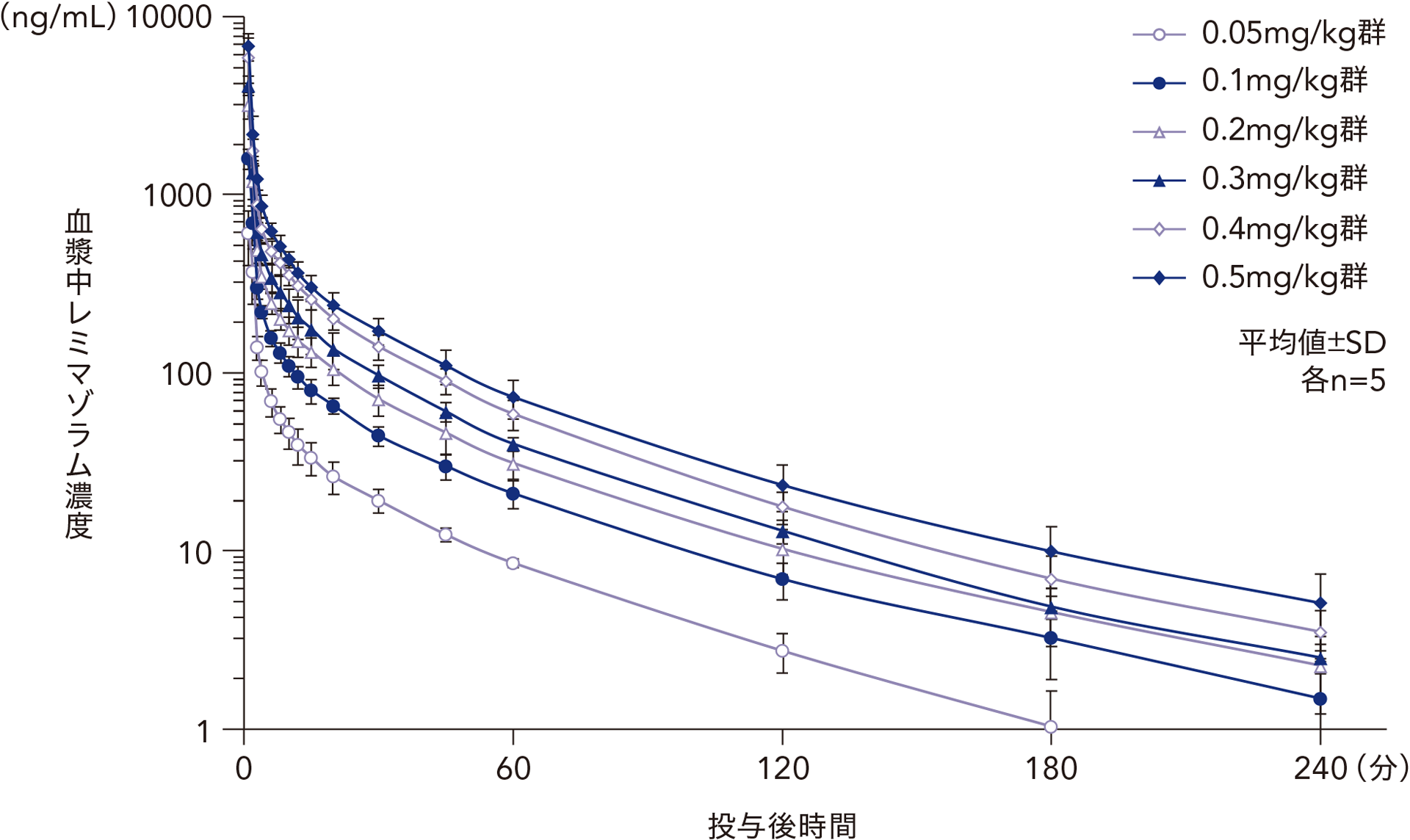
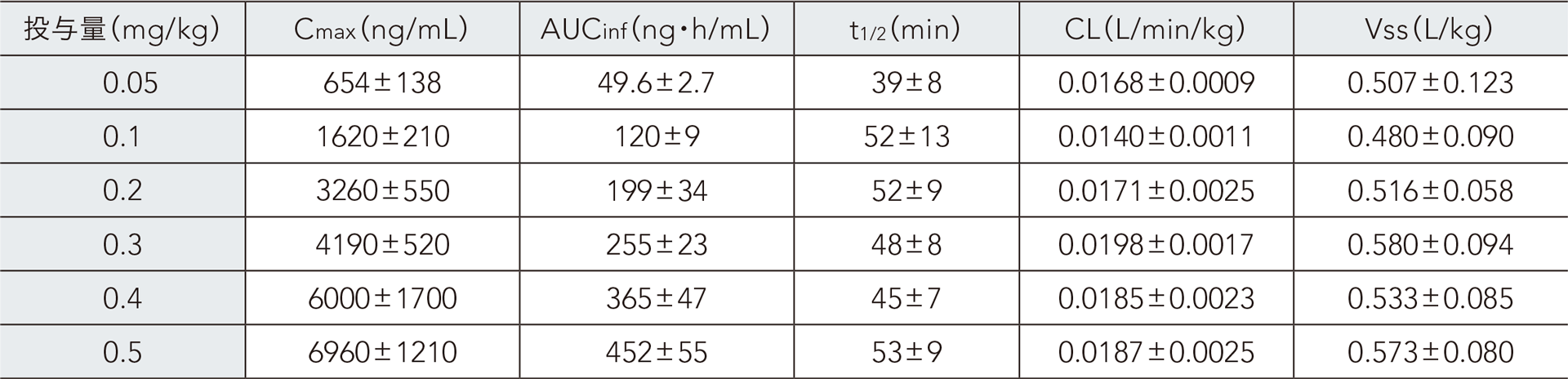
日本人健康成人男性(20~45歳)36例を対象とし、30例にレミマゾラムを0.05、0.1、0.2、0.3、0.4、0.5mg/kg、6例にプラセボを1分間かけて単回静脈内急速投与した。レミマゾラム投与群のみを対象として薬物動態解析を実施した結果、Cmax 及びAUCinfは用量依存的に増加した。
健康成人男性にレミマゾラムを単回静脈内急速投与したときの血漿中レミマゾラム濃度の推移
健康成人男性にレミマゾラムを単回静脈内急速投与したときの血漿中レミマゾラムの薬物動態パラメータ(ノンコンパートメント解析)
動脈血漿データ、各n=5、平均値±SD
健康成人男性にレミマゾラムを単回静脈内急速投与したときの血漿中レミマゾラムの薬物動態パラメータ(3-コンパートメント解析)
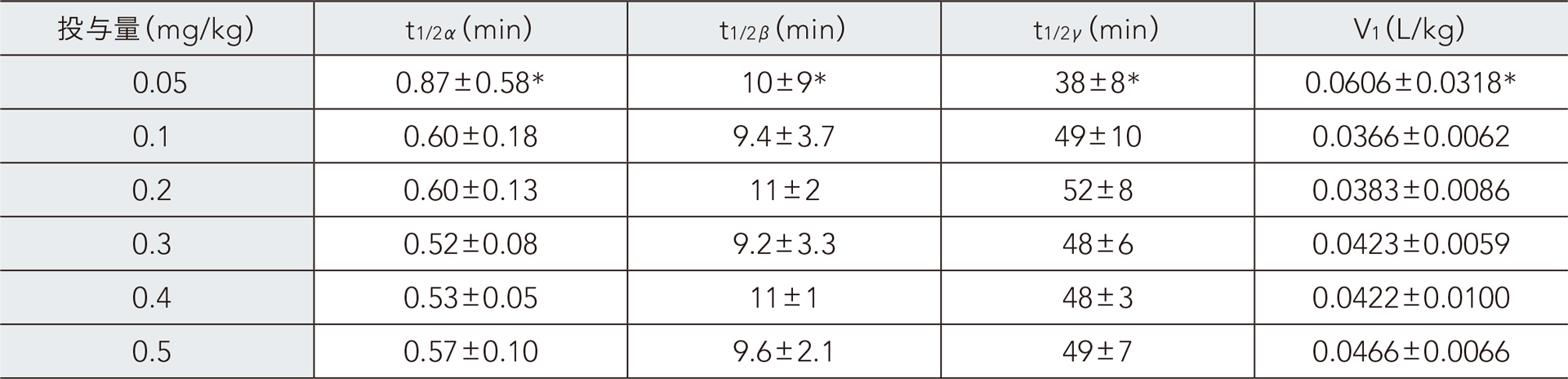
平均値±SD、各n=5、*:n=4(1例は3-コンパートメントモデルに当てはまらなかったため除外した。)
対象:日本人健康成人男性(20~45歳)36例
方法:レミマゾラム0.05、0.1、0.2、0.3、0.4、0.5mg/kg、あるいはプラセボを1分間かけて単回静脈内急速投与した。
(2)単回静脈内持続投与2)
日本人健康成人男性(20~45歳)10例を対象とし、投与速度1mg/kg/時にてレミマゾラム(n=8)又はプラセボ(n=2)を単回静脈内持続投与した。投与時間は最大1時間とし、意識消失から10分間で投与終了とした。
その結果、AUCinf、t1/2、及びCLは動脈血と静脈血で同程度であったが、静脈血に比べ動脈血のCeoi が高値、Vss が低値を示した。
健康成人男性にレミマゾラムを投与速度1mg/kg/時で単回静脈内持続投与したときの血漿中レミマゾラムの薬物動態パラメータ
(ノンコンパートメント解析)
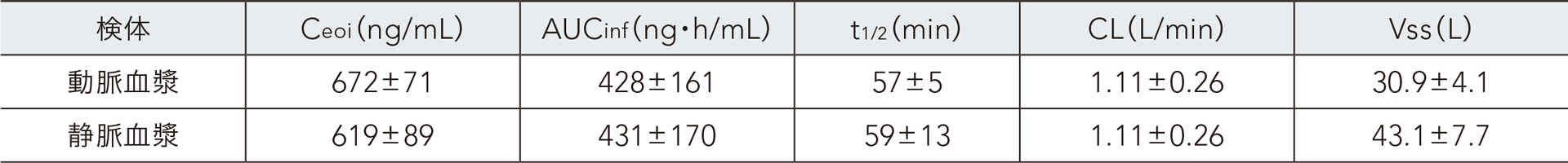
平均値±SD、n=8、Ceoi:投与終了直前の血漿中濃度
対象:日本人健康成人男性(20~45歳)10例
方法:投与速度1mg/kg/時にてレミマゾラム(n=8)又はプラセボ(n=2)を単回静脈内持続投与した。
(3)高齢者における血漿中濃度1)
日本人健康成人男性を対象とした試験において、非高齢者(20~40歳)5例及び高齢者(65~73歳)5例にレミマゾラム0.1mg/kgを1分間かけて単回静脈内急速投与した。その結果、非高齢者と高齢者の薬物動態に違いはなかった。
非高齢男性及び高齢男性にレミマゾラム0.1mg/kgを単回静脈内急速投与したときの血漿中レミマゾラム濃度の推移
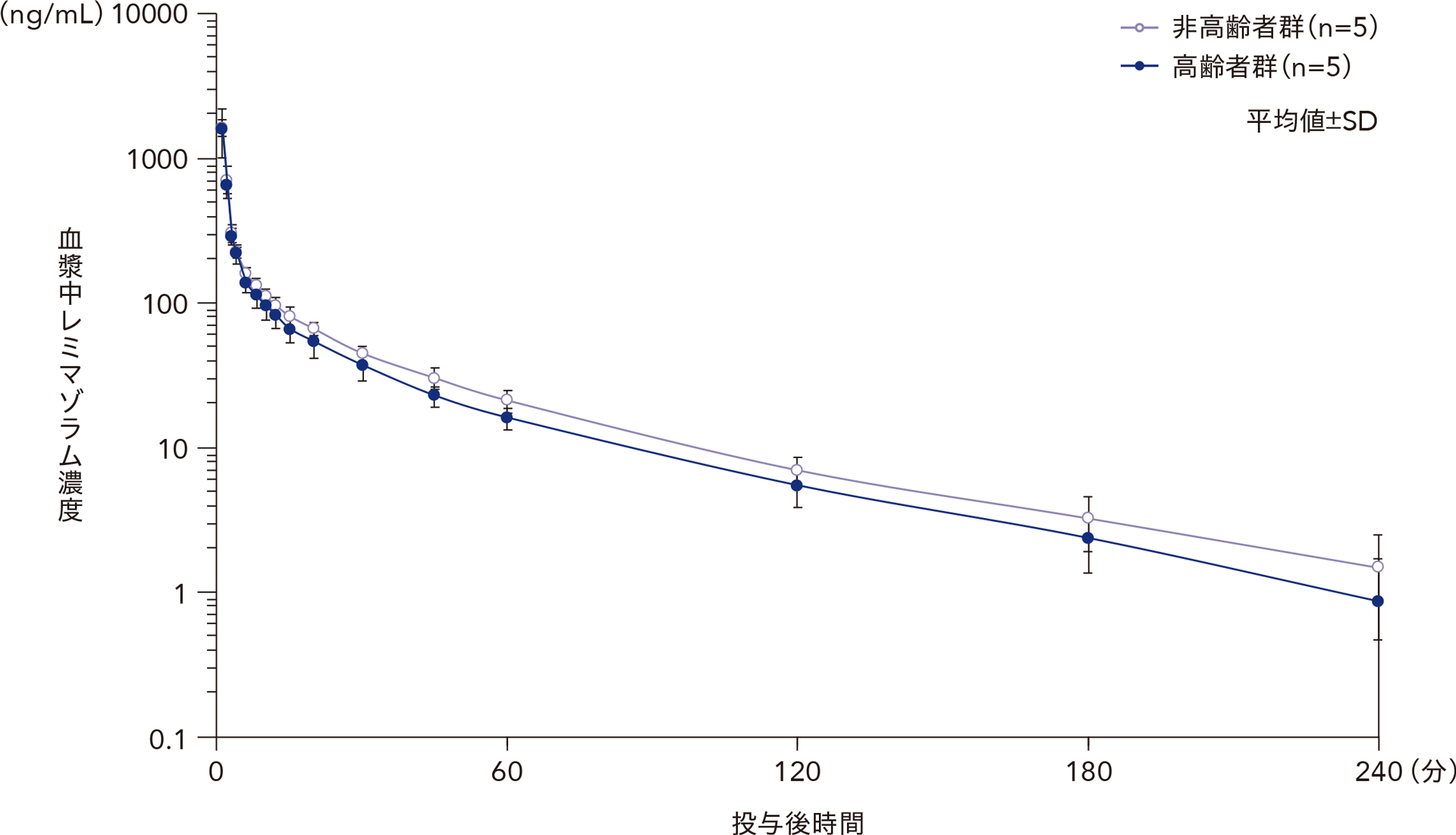
非高齢健康成人男性及び健康高齢男性にレミマゾラム0.1mg/kgを単回静脈内急速投与したときの血漿中レミマゾラムの
薬物動態パラメータ(ノンコンパートメント解析)
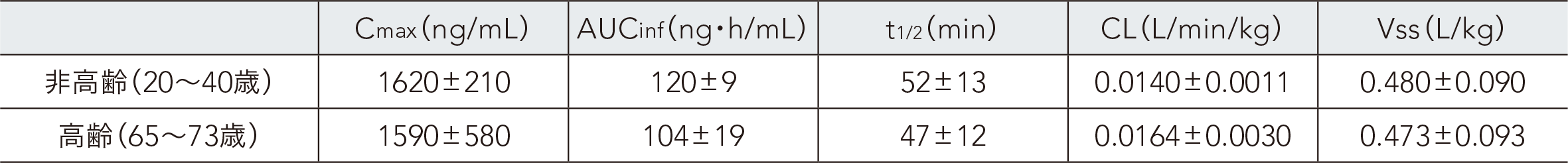
動脈血漿データ、各n=5、平均値±SD
対象:日本人の非高齢健康成人男性(20~40歳)5例、健康高齢男性(65~73歳)5例
方法:レミマゾラム0.1mg/kgを1分間かけて単回静脈内急速投与した。
(4)肝機能障害患者における血漿中濃度(外国人データ)3)
28~64歳の中等度肝機能障害(Child-Pugh 分類B)患者8例、高度肝機能障害(Child-Pugh 分類C)患者3例、及び健康成人9例を対象とし、レミマゾラム0.1mg/kg を1分間かけて単回静脈内急速投与した(健康成人群1例はPK解析対象集団から除外)。その結果、血漿中レミマゾラムのt1/2及びVssは、肝機能障害の重症度が高いほど延長又は増加した。AUCinf は健康成人群と中等度肝機能障害患者群で同程度であったが、高度肝機能障害患者群では健康成人群の約1.3倍であった。
健康成人及び肝機能障害患者にレミマゾラム0.1mg/kgを単回静脈内急速投与したときの血漿中レミマゾラム濃度の推移
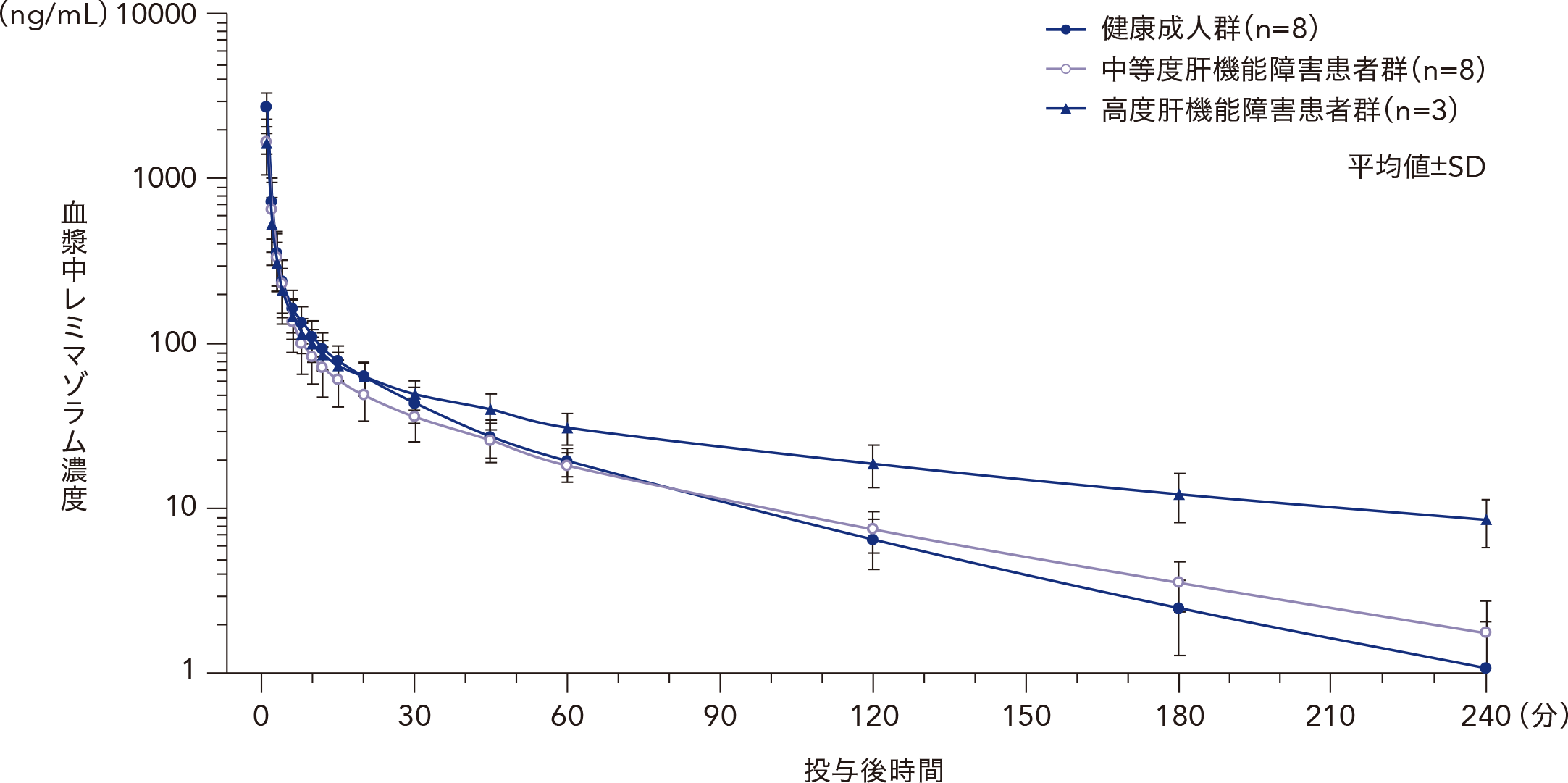
健康成人及び肝機能障害患者にレミマゾラム0.1mg/kgを単回静脈内急速投与したときの血漿中レミマゾラムの薬物動態
パラメータ(ノンコンパートメント解析)
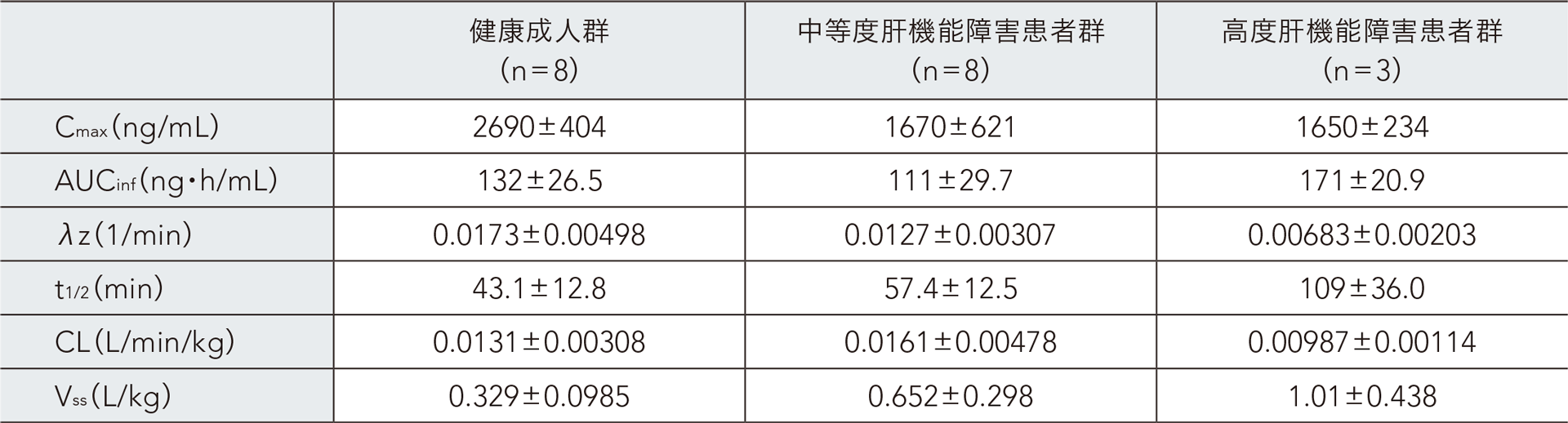
平均値±SD
対象:28~64歳の中等度肝機能障害(Child-Pugh分類B)患者8例、高度肝機能障害(Child-Pugh分類C)患者3例、健康成人8例
方法:レミマゾラム0.1mg/kgを1分間かけて単回静脈内急速投与した。
(5)腎機能障害患者における血漿中濃度(外国人データ)4)
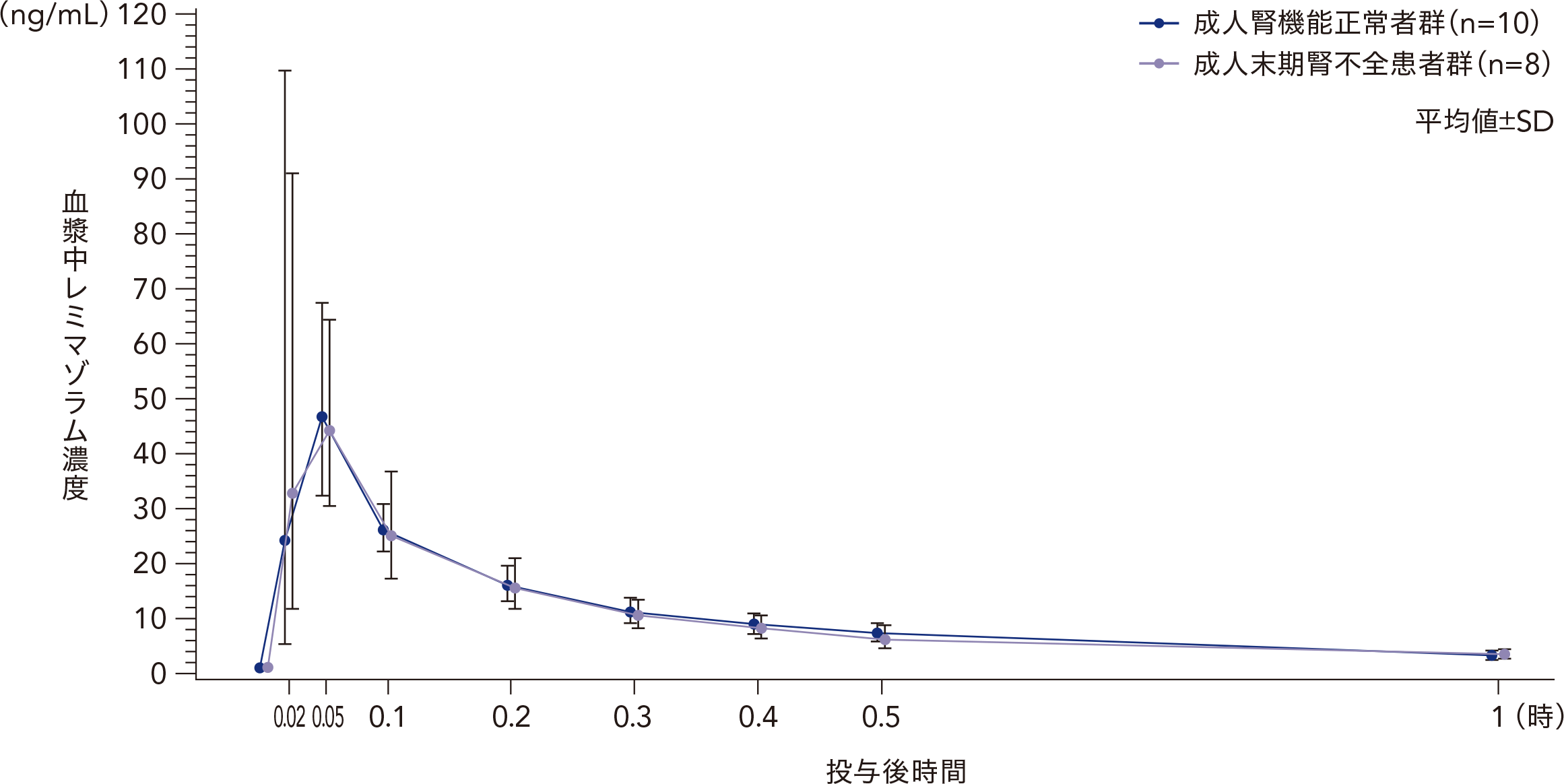
27~57歳の末期腎不全患者[eGFR(mL/ 分/1.73m2):15以上30未満が4例、15未満が4例]8例、腎機能正常者[eGFR(mL/ 分/1.73m2):80以上]10例を対象とし、レミマゾラム1.5mgを単回静脈内急速投与した。その結果、血漿中レミマゾラムの薬物動態パラメータは、成人腎機能正常者群と成人末期腎不全患者群で同様であった。
成人腎機能正常者及び成人末期腎不全患者にレミマゾラム1.5mgを単回静脈内急速投与したときの血漿中レミマゾラム
濃度の推移
成人腎機能正常者及び成人末期腎不全患者にレミマゾラム1.5mgを単回静脈内急速投与したときの血漿中レミマゾラムの薬物動態パラメータ
(ノンコンパートメント解析)
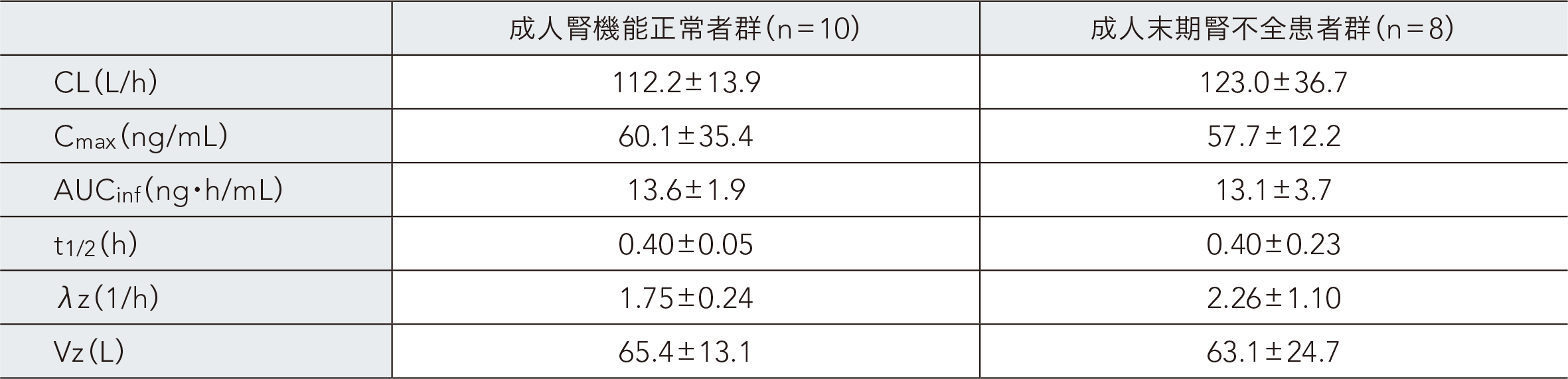
平均値±SD
対象:27~57歳の末期腎不全患者[eGFR(mL/ 分/1.73m2):15以上30未満が4例、15未満が4例]8例、腎機能正常者[eGFR(mL/ 分/1.73m2):80以上]10例
方法:レミマゾラム1.5mgを単回静脈内急速投与した。
2.分布
■組織内分布(ラット、サル)5,6)
レミマゾラムの組織内分布は、ラット(SD)、カニクイザルに14C-レミマゾラム10mg/kgを単回静脈内急速投与し、投与後の各組織への移行並びに経時推移の特性を検討した。その結果、投与後の短いt1/2及び速やかで広範囲の組織分布が示され、いずれの組織においても蓄積はほとんどみられないことが示され、メラニン色素を含む眼組織に移行するものの血漿中濃度の消失に伴い同様の推移を示した。
■乳汁移行性(ラット)7)
分娩後11日の授乳中ラット(SD)に14C-レミマゾラム10mg/kgを単回静注内急速投与して乳汁中移行を検討した結果、レミマゾラム及び代謝物は乳汁中に移行するが母動物の血漿中濃度の消失と同様の濃度推移を示した。
■胎盤透過性(ラット)5)
妊娠17日のラットに14C-レミマゾラム10mg/kgを単回急速静注したときの胎児血液及び胎児放射能濃度は、投与後5分においてそれぞれ母動物血漿の0.07及び0.05倍であり、投与後48時間では投与後5分の1%未満となった。
■血球移行性(in vitro)8)
14C-レミマゾラム(添加濃度1~10μg/mL)をヒト血液と37℃で5分間インキュベートしたところ、レミマゾラムは7.5~11.7%が血球中に移行した。
■血清タンパク結合(in vitro)9)
14C-レミマゾラムのヒト血清におけるタンパク結合を限外ろ過法により検討した。ヒト血清に14C-レミマゾラム1、3、10μg/mLを添加したとき、タンパク結合率は91.6~92.1%であり、主にアルブミンと結合した。
3.代謝(in vitro)10)
レミマゾラムは主に肝臓のカルボキシルエステラーゼ(CES、主にCES1)によって速やかにCNS7054に加水分解され代謝される。レミマゾラムの推定代謝経路を下図に示す。また、レミマゾラムの代謝にチトクロームP450は関与しなかった。
レミマゾラムの推定代謝経路
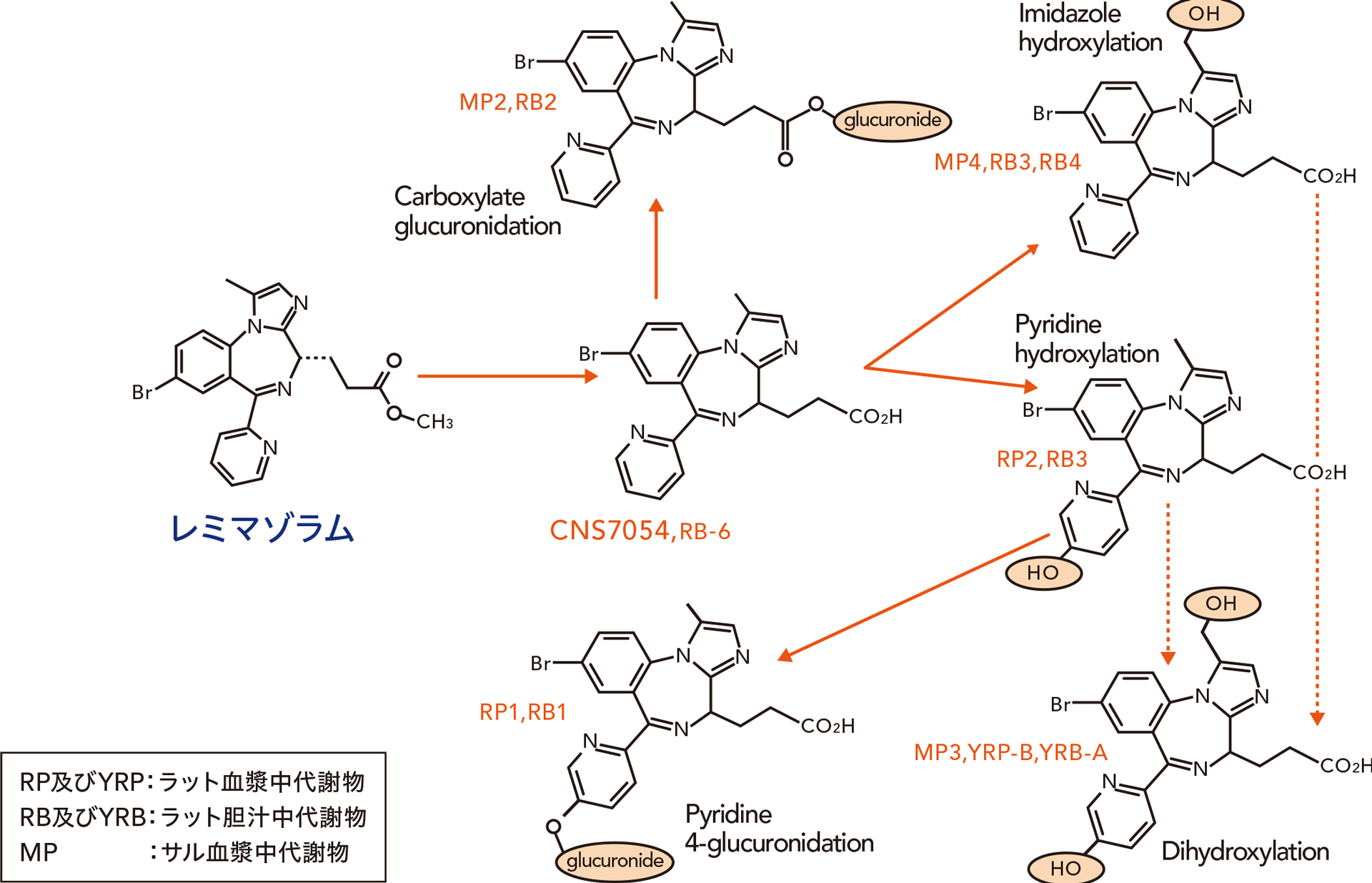
4.排泄1)
日本人健康成人男性各5例に、レミマゾラム0.2又は0.3mg/kgを単回静脈内投与したとき、投与後24時間までに未変化体は尿中から検出されず、主代謝物として80%以上が尿中に排泄された。
6. 用法及び用量
〈全身麻酔の導入及び維持〉
<導入>
通常、成人には、レミマゾラムとして12mg/kg/時の速度で、患者の全身状態を観察しながら、意識消失が得られるまで静脈内へ持続注入する。
なお、患者の年齢、状態に応じて投与速度を適宜減速すること。
<維持>
通常、成人には、レミマゾラムとして1mg/kg/時の速度で静脈内への持続注入を開始し、適切な麻酔深度が維持できるよう患者の全身状態を観察しながら、投与速度を適宜調節するが、上限は2mg/kg/時とする。なお、患者の年齢、状態に応じて投与開始速度を適宜減速すること。
覚醒徴候が認められた場合は、最大0.2mg/kgを静脈内投与してもよい。
〈消化器内視鏡診療時の鎮静〉
通常、成人には、レミマゾラムとして3 mgを、15秒以上かけて静脈内投与する。効果が不十分な場合は、少なくとも2分以上の間隔を空けて、1mgずつ15秒以上かけて静脈内投与する。なお、患者の年齢、体重等を考慮し、適切な鎮静深度が得られるよう、投与量を適宜減量する。
9. 特定の背景を有する患者に関する注意(抜粋)
9.3 肝機能障害患者
9.3.1 重度の肝機能障害患者(Child Pugh 分類C)
投与速度の減速、投与量の減量を考慮するなど患者の状態を観察しながら慎重に投与すること。本剤の代謝が遅延し、作用が強く又は長くあらわれるおそれがある。[16.6.2参照]
9.8 高齢者
投与速度の減速、投与量の減量を考慮するなど患者の状態を観察しながら慎重に投与すること。生理機能の低下により、鎮静作用の増強や低血圧、徐脈等の副作用があらわれるおそれがある。[7.4、16.6.1参照]
1)社内資料:国内第Ⅰ相臨床試験(ONO-2745-01試験、承認時評価資料)
2)社内資料:国内第Ⅰ相臨床試験(ONO-2745-02試験、承認時評価資料)
3)社内資料:海外第Ⅰ相臨床試験(健康成人及び肝機能障害患者)(ONO-2745IVU007試験、承認時評価資料)
4)社内資料:海外第Ⅰ相臨床試験(末期腎不全患者及び腎機能正常者)(CNS7056-012試験、承認時評価資料)
5)社内資料:妊娠ラットにおける組織内分布
6)社内資料:サルにおける組織内分布
7)社内資料:ラットにおける乳汁移行性
8)社内資料:in vitro分布(血球移行性)
9)社内資料:in vitro分布(タンパク結合率)
10)社内資料:in vitro代謝











