消化器内視鏡検査時の鎮静

国内臨床試験成績
本臨床試験は用量検討試験が含まれるため、一部承認外用量の成績が含まれていますが、承認時評価資料のため紹介します。
消化器内視鏡検査を受ける日本人患者を対象とした試験(REM-IICT-JP01試験:国内第Ⅱ/Ⅲ相医師主導臨床試験)1~3)
1) 社内資料:国内第Ⅱ/Ⅲ相医師主導臨床試験(REM-IICT-JP01試験、承認時評価資料)
2) Ichijima R, et al. Dig Endosc. 2024; 36(9): 995-1002[. 利益相反:本研究はムンディファーマ株式会社の資金により実施された。]
3) Ichijima R, et al. Digestion. 2024; 105(6): 448-456[. 利益相反:本研究はムンディファーマ株式会社の資金により実施された。]
目的
鎮痛薬を併用せずに消化器内視鏡検査(上部消化管及び大腸)を受ける日本人患者を対象に、用量探索ステップではアネレム®の至適用量(初回投与量及び追加投与量)を検討し、検証ステップでは用量探索ステップで決定した用量におけるアネレム®の有効性及び安全性を評価した。
試験デザイン
用量探索ステップ:単施設、非盲検、非対照試験
検証ステップ:多施設共同、無作為化、二重盲検、プラセボ対照、群間比較試験
対象
鎮痛薬を併用せず上部消化管及び大腸の消化器内視鏡検査を受ける成人患者
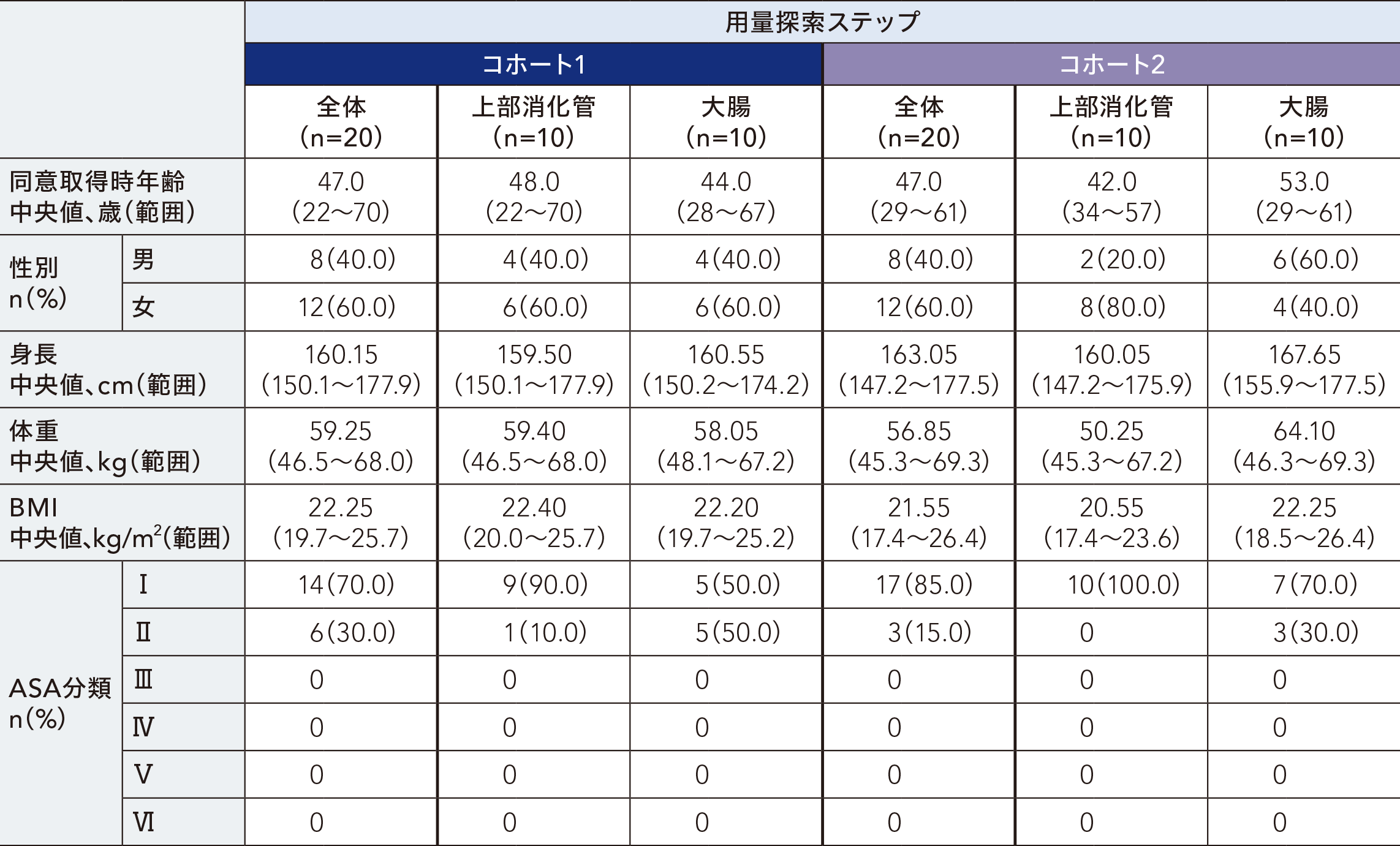
用量探索ステップ:40例(コホート1:20例、コホート2:20例、コホート3:0例)
有効性解析対象集団(Full Analysis Set:FAS):40例( コホート1:20例、コホート2:20例)
安全性解析対象集団(Safety Population:SP):40例( コホート1:20例、コホート2:20例)
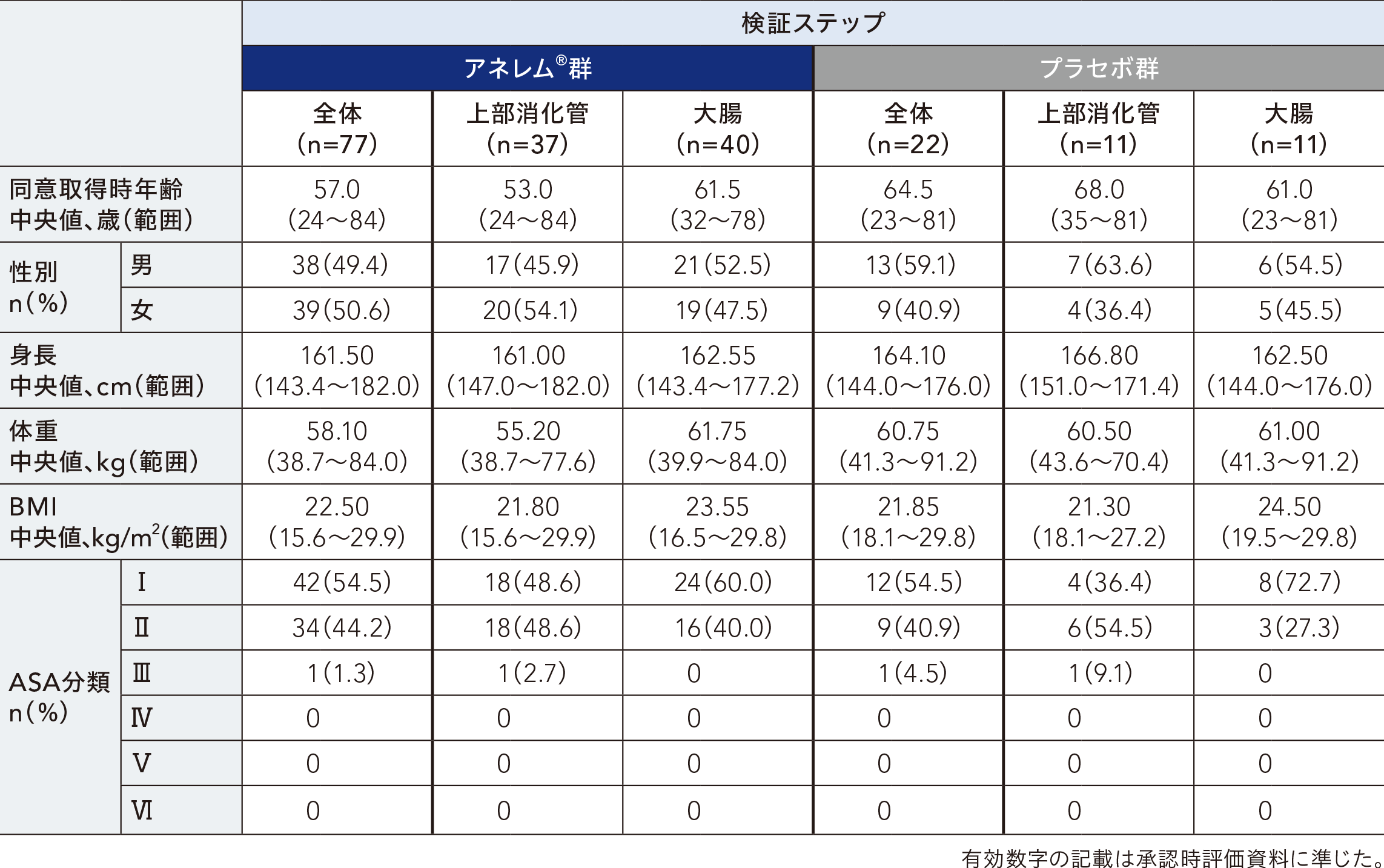
検証ステップ:99例(アネレム®群77例、プラセボ群22例)
有効性解析対象集団(FAS):99例(アネレム®群77例、プラセボ群22例)
安全性解析対象集団(SP):99例(アネレム® 群76例、プラセボ群23例)
注) アネレム®群に割り付けられた患者(上部消化管)1例に対して、プラセボが投与されていた。本症例
は有効性解析ではアネレム®群、安全性解析ではプラセボ群に含めた(2022年2月3日の症例検討会
で検討の結果)。
方法
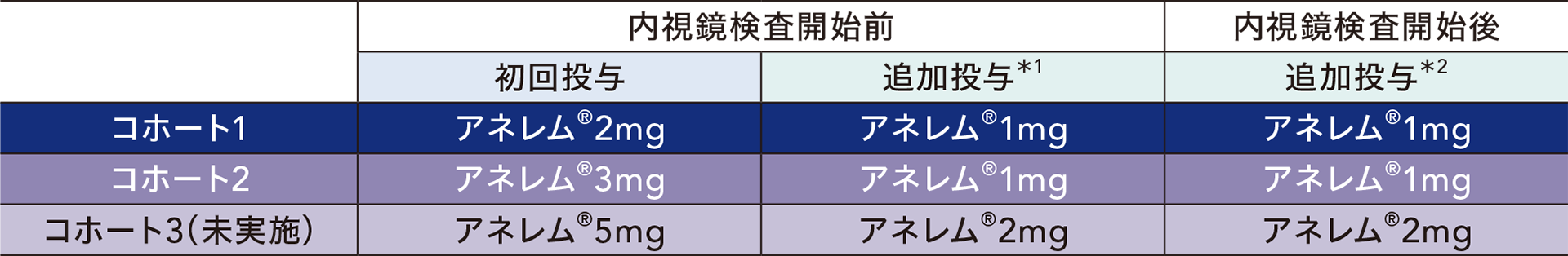
用量探索ステップ
3つの用量コホートを設け、各コホートに、上部消化管内視鏡検査及び大腸内視鏡検査を受ける患者を同数ずつ登録した。コホート1から開始し、効果安全性評価委員会が次コホートへの移行の可否、検証ステップへの移行の可否、及び検証ステップで用いるアネレム®の用量について総合的に判断した(コホート3への移行は未実施)。
用量探索ステップにおける投与方法
初回投与としてアネレム®を15秒以上の時間をかけて緩徐に単回静脈内投与した。初回投与開始時点から2分以上の間隔を空けてMOAA/Sスコアにて鎮静レベルを評価し、鎮静(MOAA/Sスコア4以下)が得られた場合は、消化器内視鏡検査を開始した。内視鏡検査開始前後は必要に応じて1回アネレム®1mgずつ追加投与した。
主な選択基準:20~74歳、ASA分類Ⅰ~Ⅱ、体重45~70kg、BMI<30kg/m2
*1:追加投与の上限は5回までとした。
*2: 内視鏡検査開始後に覚醒徴候(MOAA/Sスコア5や体動等)が認められ、治験責任/分担医師が追加投与を必要と判断した場合は、アネレム®の追加投与を可とした。

用量探索ステップにおけるコホート移行の目安
以下の有効性と安全性の基準をともに満たす場合、次のコホートに移行することとした。
有効性:
1. 内視鏡検査開始前の追加投与なしで内視鏡検査開始前に鎮静が得られた患者の割合が50%以下(20例中10例以下)
2. 内視鏡検査開始前の追加投与[初回投与量と追加投与量を合計した総投与量が次のコホートの初回投与量以下(コホート3の場合は、総投与量7mg*3 以下)まで]を含めての消化器内視鏡検査における鎮静の成功割合が70%未満(20例中13例以下)
*3:コホート3において、追加投与1回(初回投与量5mg、追加投与量2mg の合計7mg)で鎮静が得られる投与量を基準とした。
安全性:
3. アネレム®投与後に、緊急的にアネレム®による鎮静の拮抗のためのフルマゼニルを投与された患者が20例中1例以下
4. 用手換気の実施が20例中1例以下
5. 意識消失(連続する2時点以上でMOAA/Sスコア1以下)を認めた患者が20例中4例以下
方法
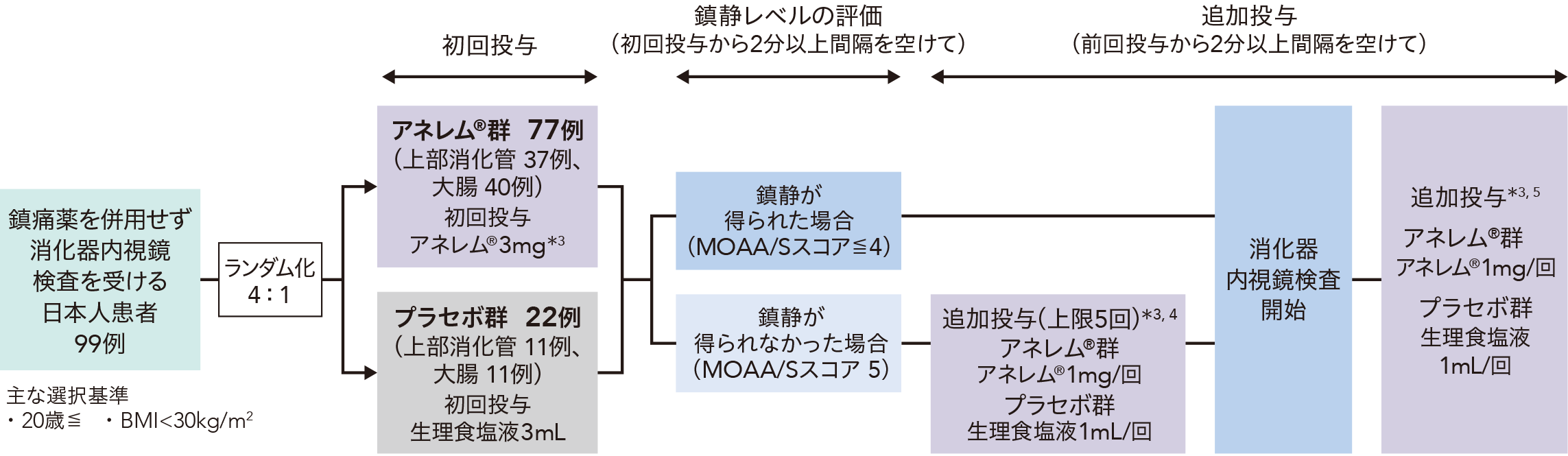
検証ステップ
上部消化管内視鏡検査及び大腸内視鏡検査を受ける患者を同数ずつ登録し、それぞれアネレム®群とプラセボ群に4 : 1の割合で無作為に割り付けた。
検証ステップにおける投与方法
<内視鏡検査開始前>
初回投与としてアネレム®3mgを15秒以上の時間をかけて緩徐に単回静脈内投与した。初回投与開始時点から2分以上の間隔を空けてMOAA/Sスコアにて鎮静レベルを評価し、鎮静(MOAA/Sスコア4以下)が得られた場合は、消化器内視鏡検査を開始した。鎮静が得られない場合、前回投与から2分以上間隔を空けてアネレム®1mgを追加投与した。3回目以降の追加投与の可否は、安全性を踏まえて治験責任/分担医師が判断した(追加投与上限:5回)。追加投与しても鎮静が得られない場合は「治験薬は無効」と判断し、以降の追加投与は不要としたうえで、消化管内視鏡検査を開始した。プラセボ群も同様に実施した。
<内視鏡検査開始後>
内視鏡検査開始後に覚醒徴候(MOAA/Sスコア5や体動等)が認められ、治験責任/分担医師が追加投与を必要と判断した場合は、アネレム®1mgの追加投与を可とした。なお、鎮静が得られずに内視鏡検査を開始した場合は、追加投与しないこととした。
*3:75歳以上の高齢者又は45kg未満の低体重者はアネレム®の投与量を半量に減量可とした。
*4: 追加投与しても鎮静が得られなかった場合、「治験薬は無効」と判断し、追加投与は不要としたうえで、消化管内視鏡検査を開始した。
*5: 内視鏡検査開始後に覚醒徴候(MOAA/Sスコア5や体動等)が認められ、治験責任/分担医師が追加投与を必要と判断した場合は、アネレム®の追加投与を可とした。
【評価項目】
〈主要評価項目〉
消化器内視鏡検査における鎮静の成功*6 割合(検証ステップ)(検証的な解析項目
*6:消化器内視鏡検査における鎮静の成功の定義
以下のすべてを満たす場合に成功とする。
●内視鏡検査開始前に鎮静(MOAA/Sスコア4以下)が得られる
●消化器内視鏡検査の完遂
●内視鏡検査開始後の追加投与の回数が上部消化管内視鏡検査では6分間当たり2回、大腸内視鏡検査では15分間当たり5回を超えない
〈副次評価項目〉
検証ステップ
内視鏡検査開始前に鎮静が得られた患者の割合、アネレム®の初回投与から鎮静が得られるまでの時間、鎮静が得られるまでのアネレム®の投与量(内視鏡検査開始までの総投与量)、アネレム®/プラセボ最終投与後から歩行できるまでの時間、内視鏡検査終了から歩行できるまでの時間、患者評価(5段階評価)[参考情報]、医師評価(5段階評価)[参考情報] 等
〈安全性評価項目〉
有害事象、臨床検査(血液学的検査、血液生化学検査及び尿検査)、バイタルサイン(血圧、心拍数、呼吸数、SpO2)、心電図検査(12誘導心電図、モニター心電図)、投与部位血管痛の有無、覚醒後の再鎮静の有無(フルマゼニル投与例の再鎮静の有無を含む)、意識消失、酸素投与、用手換気、緊急的なフルマゼニルの投与、内視鏡医以外の医師による緊急対応の有無
【解析計画】
主要評価項目である消化器内視鏡検査における鎮静について、成功割合及び両側95%CIを算出した。アネレム®群とプラセボ群の群間差を算出し、Fisherの直接確率検定により優越性を検証した。
副次評価項目について、基本統計量、患者割合や両側95%CI等を算出した。内視鏡検査開始前に鎮静が得られた患者の割合は成功割合及び両側95%CIを算出し、群間差をFisherの直接確率検定により比較した。アネレム®の初回投与から鎮静が得られるまでの時間は、Kaplan-Meier曲線を作成した。アネレム®/プラセボ最終投与後から歩行できるまでの時間、内視鏡検査終了から歩行できるまでの時間は、Kaplan-Meier曲線を作成し、Log-rank検定により比較した。患者評価、医師評価は、5段階評価を3分類に集約した。
安全性評価項目における安全性解析対象集団は、アネレム®又はプラセボを投与されたすべての患者とし、ステップごとに解析を行った。
患者背景[FAS]
用量探索ステップ及び検証ステップの有効性解析集団における患者背景は以下のとおりであった。
<用量探索ステップ>
用量探索ステップにおけるコホート移行の目安の判定結果
コホート2の用量(初回投与量3mg、追加投与量1mg/回)において有効性が認められ、忍容性に問題がないことが確認された。

*1:次コホートへ移行する目安への該当性
有効性
<検証ステップ>
消化器内視鏡検査における鎮静の成功割合[主要評価項目、FAS]
消化器内視鏡検査における鎮静の成功割合(検証的な解析項目)は、アネレム®群で93.5%[95%CI:85.5, 97.9]、プラセボ群で4.5%[0.1, 22.8]であり、群間差は89.0%[68.7, 94.6]であった。プラセボ群と比較してアネレム®群の成功割合が有意に高いことが示された(p<0.0001、Fisherの直接確率検定)。
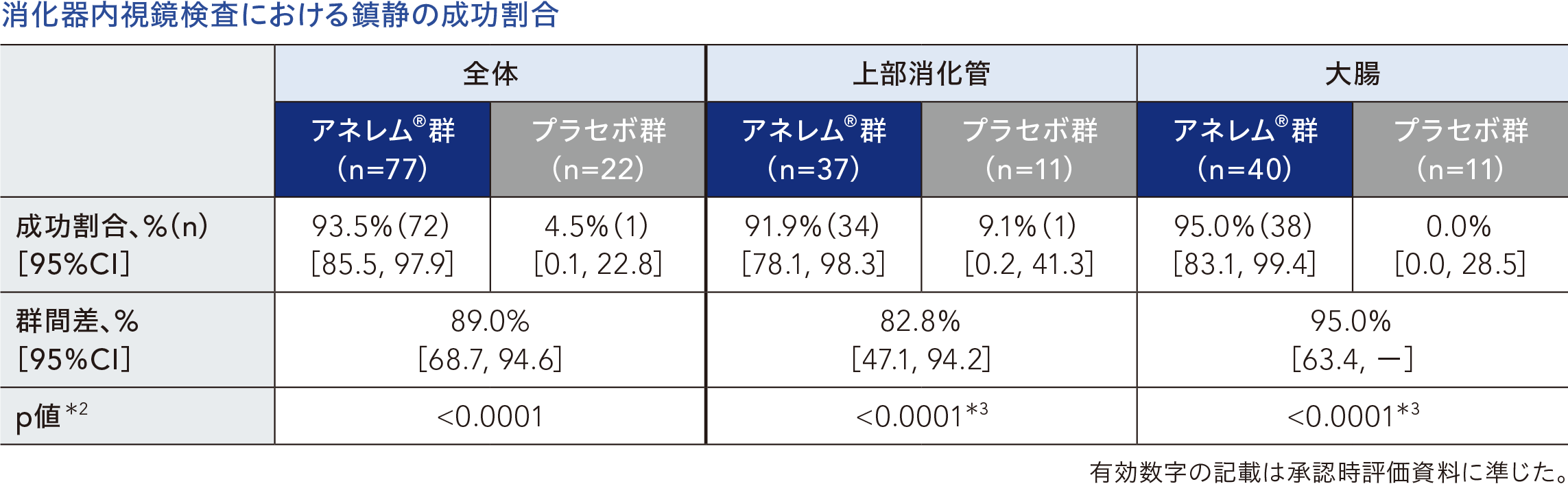
*2: Fisherの直接確率検定
*3:名目上のp値
副次評価項目[FAS]
内視鏡検査開始前に鎮静が得られた患者の割合、アネレム®の初回投与から鎮静が得られるまでの時間、鎮静が得られるまでのアネレム®の投与量(内視鏡検査開始までの総投与量)、アネレム®/プラセボ最終投与後から歩行できるまでの時間、内視鏡検査終了から歩行できるまでの時間について評価した結果は以下の表のとおりであった。
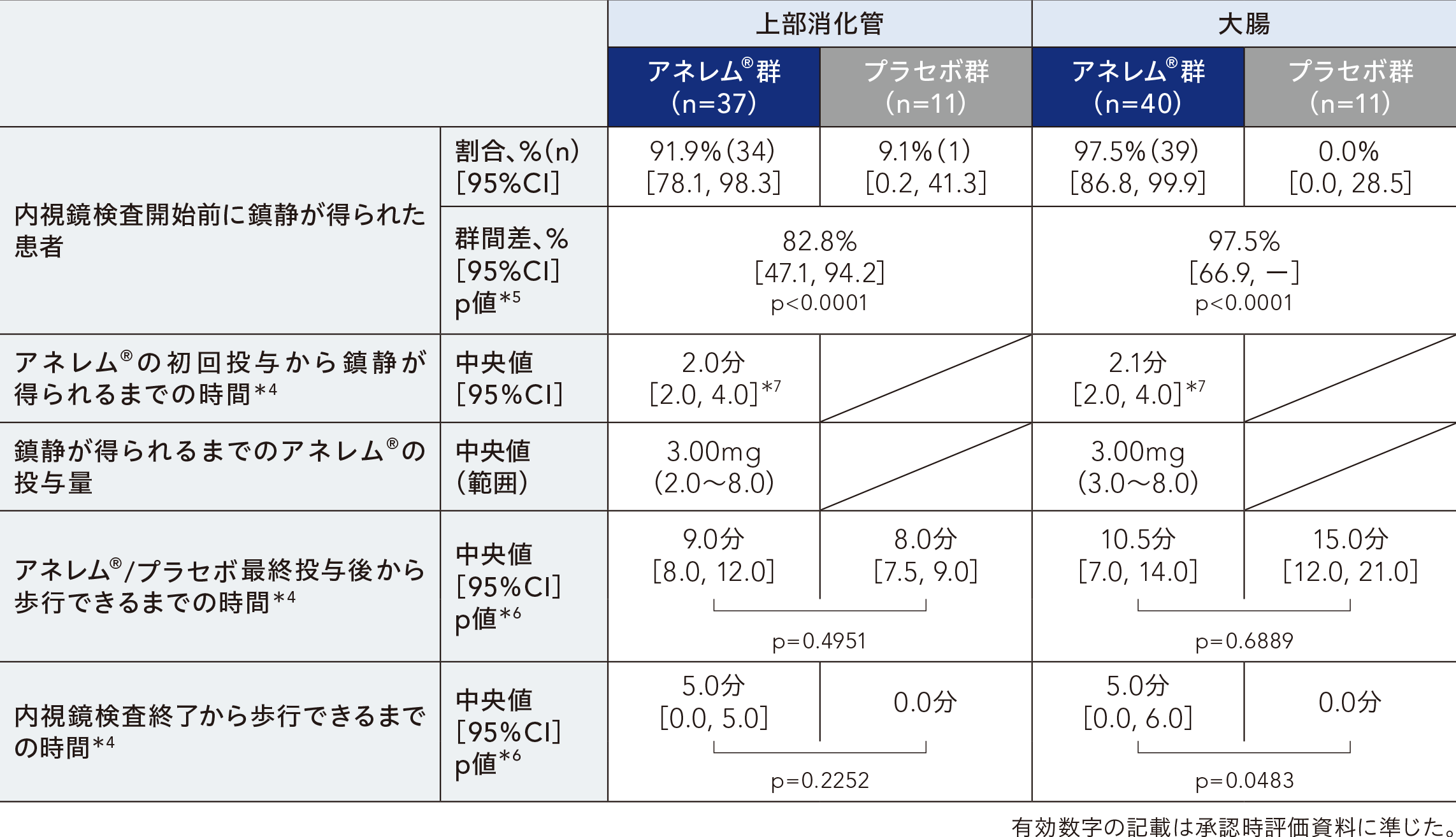
*4:Kaplan-Meier法を用いて算出した。
*5:名目上のp値、Fisherの直接確率検定
*6:名目上のp値、Log-rank検定
*7:上部消化管 n=34、大腸 n=39
<補足情報>


安全性
副作用[安全性評価項目、SP]
アネレム®投与例全体における副作用発現率は16.4%(19/116例)であった。3例以上に認められた副作用は、傾眠6.0%(7/116例)、倦怠感3.4%(4/116例)、頭痛2.6%(3/116例)であった。
用量探索ステップにおいて、コホート1の安全性解析対象集団20例のうち副作用発現率は10.0%(2/20例)であり、副作用は浮動性めまい及び頭痛 各5.0%(1/20例)であった。コホート2の安全性解析対象集団20例のうち副作用発現率は15.0%(3/20例)であり、副作用は腹痛、心窩部不快感及び倦怠感 各5.0%(1/20例)であった。
検証ステップにおいて、安全性解析対象集団99例のうち副作用発現率は、アネレム®群で18.4%(14/76例)、プラセボ群で0.0%であった。主な副作用はアネレム®群で傾眠9.2%(7/76例)、倦怠感3.9%(3/76例)、頭部不快感、低血圧及び頭痛 各2.6%(2/76例)であった。
試験の中止に至った有害事象は、検証ステップにおいてプラセボ群の大腸内視鏡検査を受けた患者1例に1件(疼痛)認められた。
本試験において、重篤な有害事象、死亡は認められなかった。
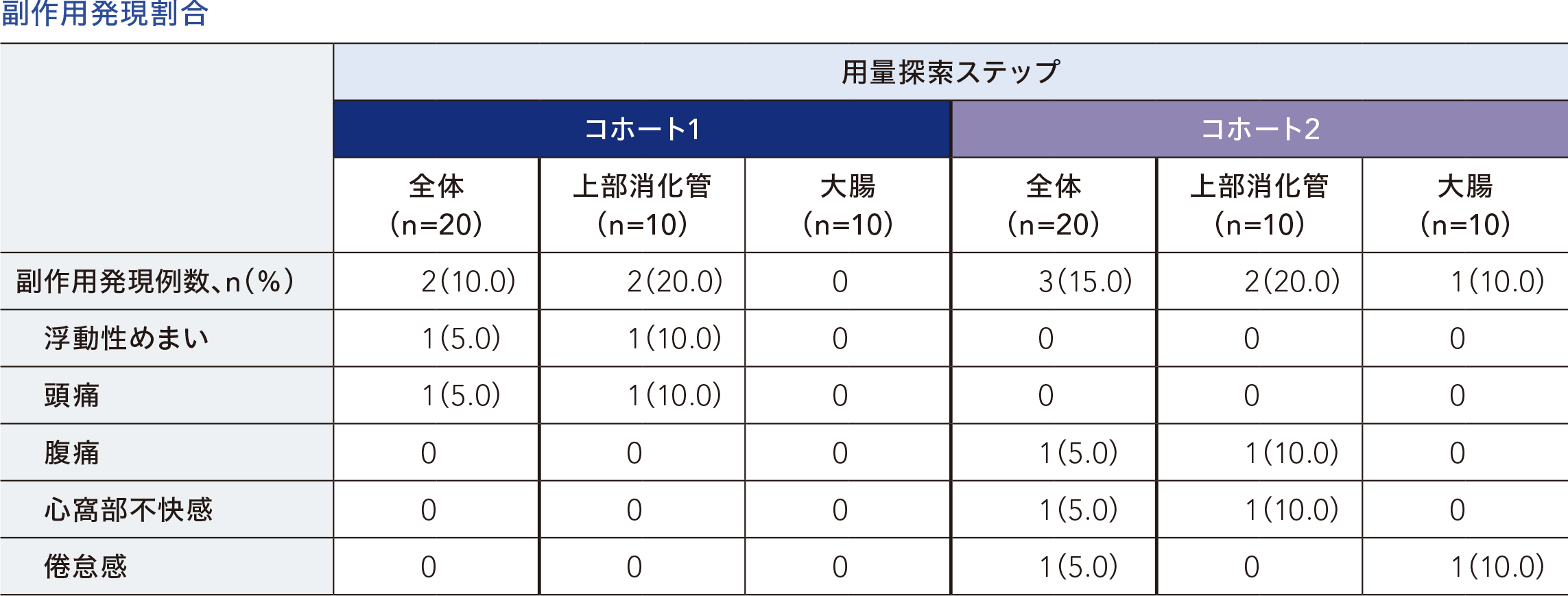
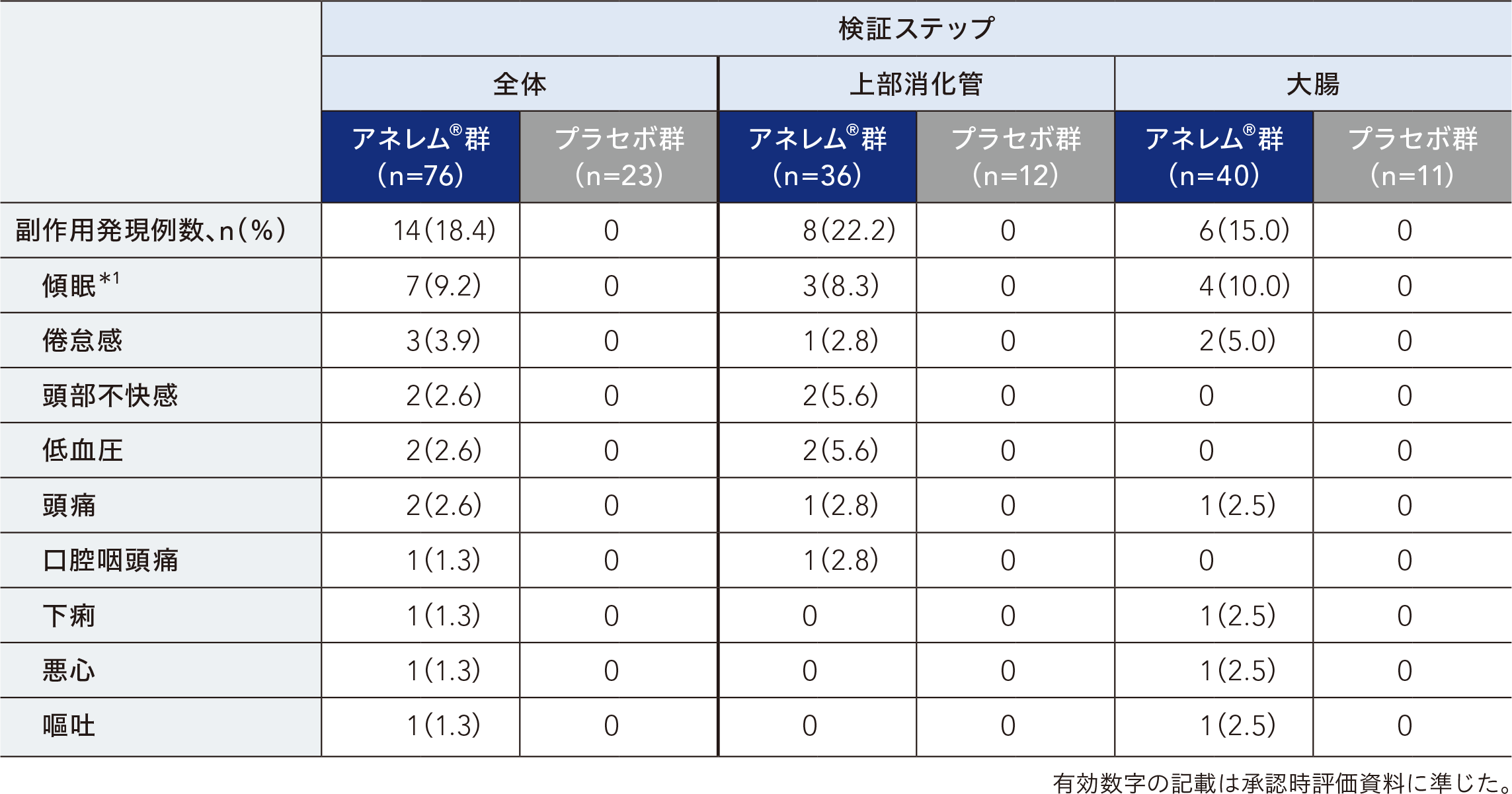
集計に用いた用語はMedDRA v24.1に準じた。
*1:傾眠の内訳は、ふらつき4例(軽度4例)、眠気2例(軽度1例、中等度1例)、傾眠1例(軽度1例)であった。
重症度はCTCAE v5.0 に準じて判定した(軽度:Grade 1、中等度:Grade 2、高度:Grade 3-5)。
臨床検査値、バイタルサイン、心電図検査の評価
試験期間を通して、臨床検査に関わる有害事象は認められなかった。低血圧がアネレム®群の2例(いずれも検証ステップで上部消化管内視鏡検査を受けた患者)に認められた。心拍数、呼吸数及びSpO2に臨床的に意義のある変動は認められなかった。なお、アネレム®群の3例(いずれも検証ステップで上部消化管内視鏡検査を受けた患者1例、大腸内視鏡検査を受けた患者2例)に酸素が投与された。ベースライン時から内視鏡検査終了60分後までの心電図において、臨床的に意義のある変動は認められなかった。
その他の安全性評価項目
試験期間を通して、投与部位血管痛は認められなかった。
覚醒後の再鎮静及びふらつき、転倒、意識消失は認められなかった。
用手換気が実施された患者はいなかった。
また、緊急的にフルマゼニルを投与された患者はおらず、内視鏡医以外の医師による緊急対応を受けた患者も認められなかった。
<補足情報>
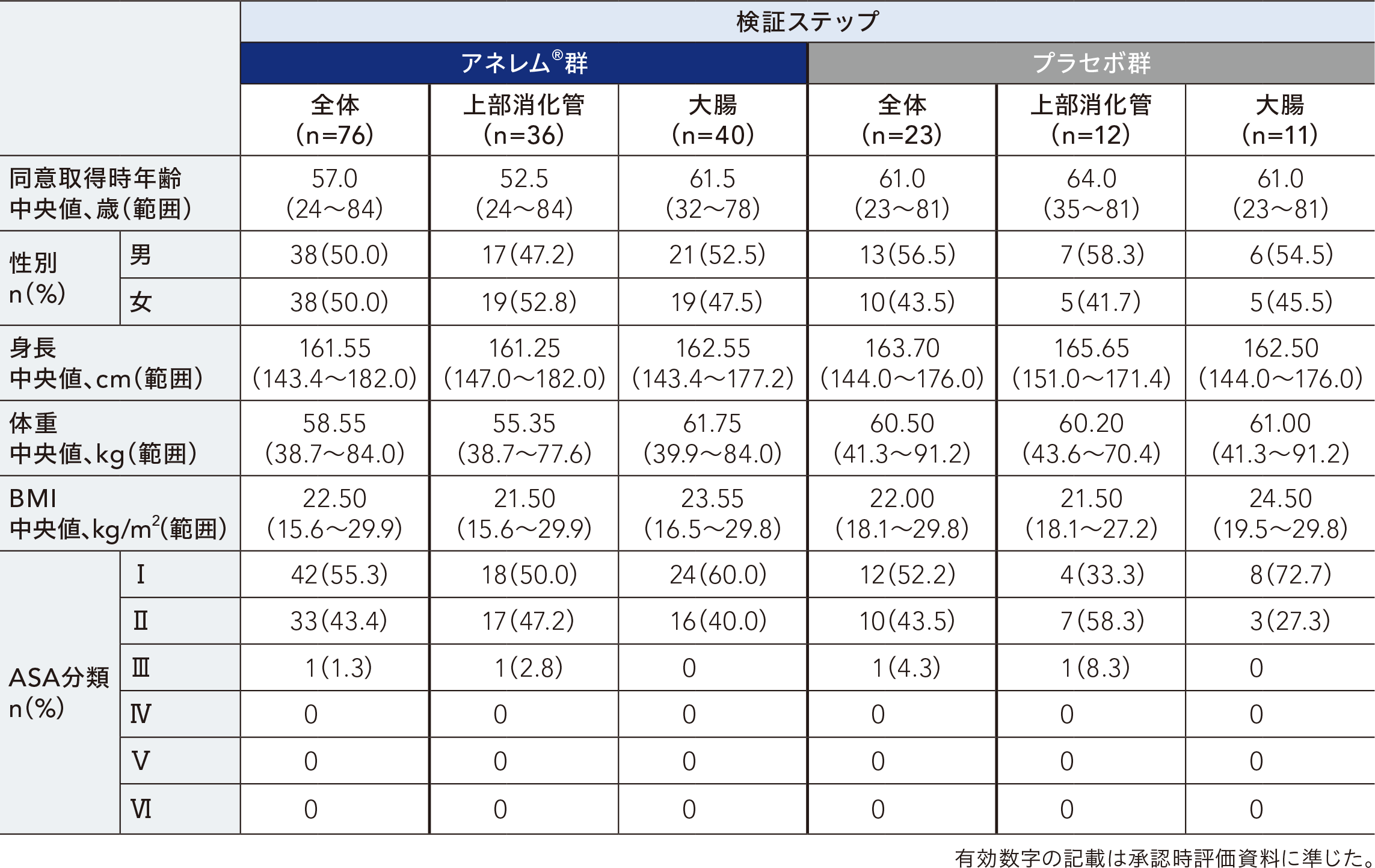
患者背景[SP]
検証ステップの安全性解析対象集団における患者背景は以下のとおりであった。なお、用量探索ステップの患者背景は有効性解析対象集団と同一のため、記載は省略した。
<参考情報>
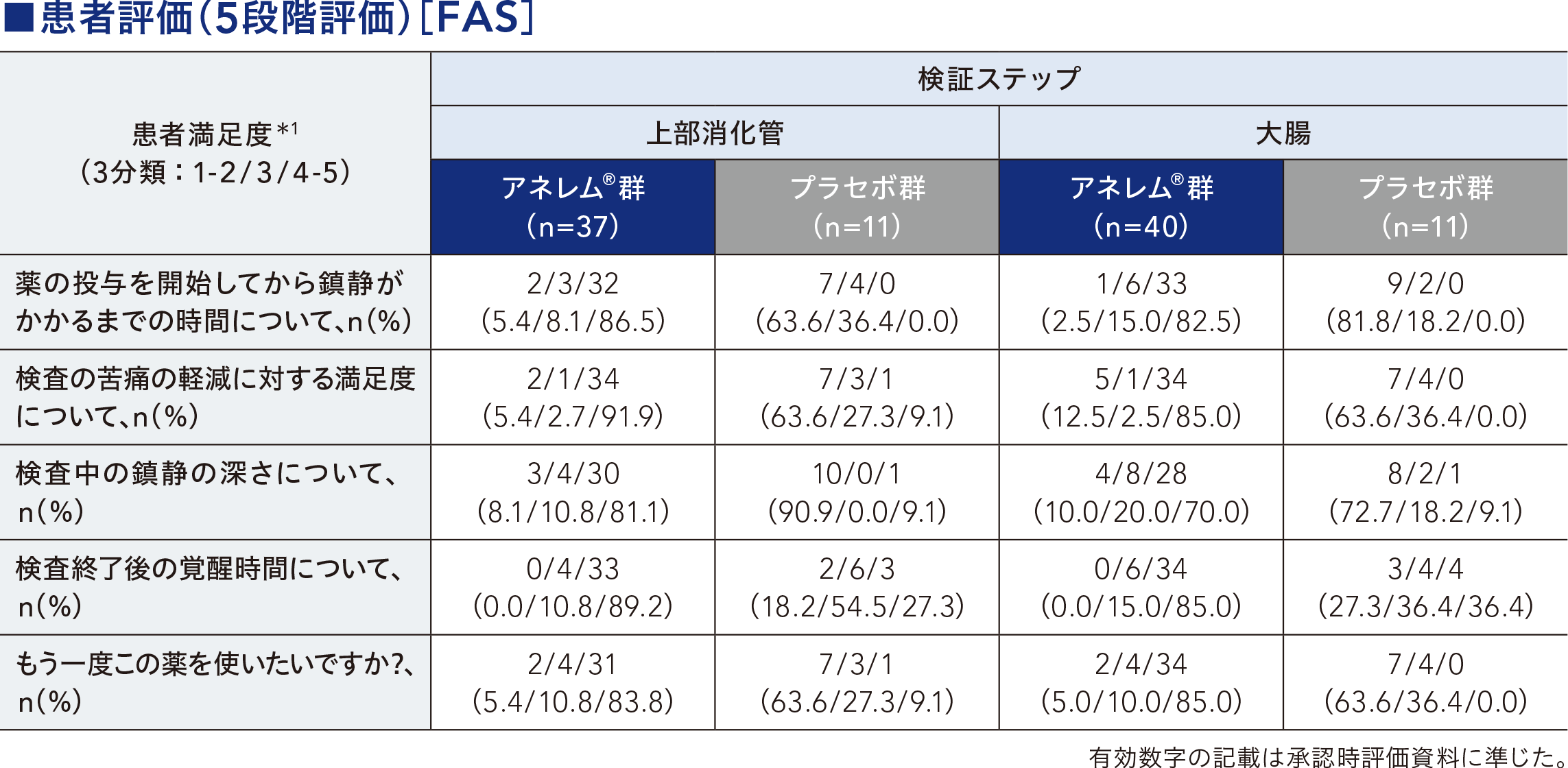
*1:1:非常に不満、 2:不満、 3:どちらでもない、 4:満足、 5:非常に満足
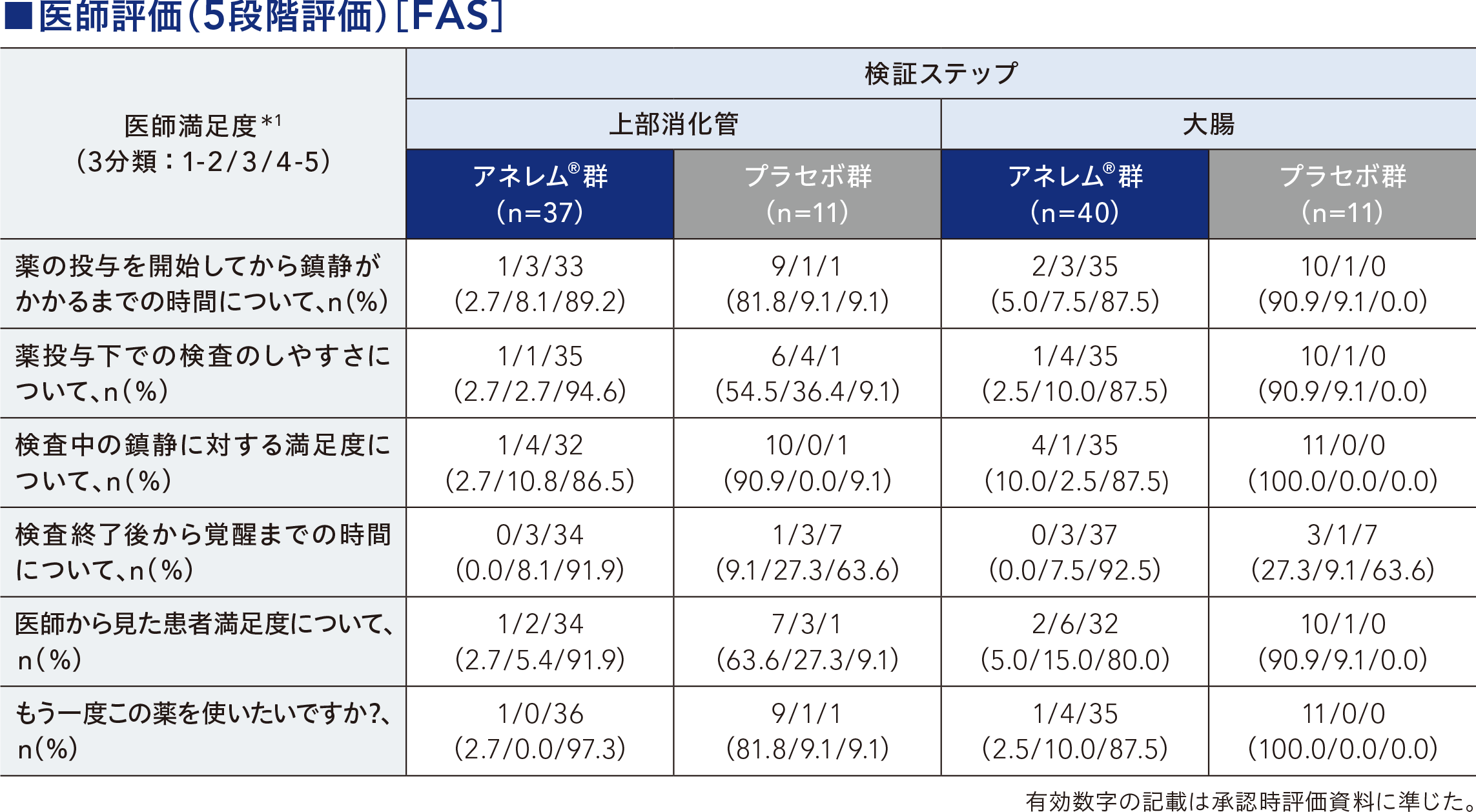
*1:1:非常に不満、 2:不満、 3:どちらでもない、 4:満足、 5:非常に満足
注) アネレム®群に割り付けられた患者(上部消化管)1例に対して、プラセボが投与されていた。本症例は有効性解析ではアネレム®群、安全性解析ではプラセボ群に含めた。
6.用法及び用量(抜粋)
〈消化器内視鏡診療時の鎮静〉
通常、成人には、レミマゾラムとして3mgを、15秒以上かけて静脈内投与する。効果が不十分な場合は、少なくとも2分以上の間隔を空けて、1mgずつ15秒以上かけて静脈内投与する。なお、患者の年齢、体重等を考慮し、適切な鎮静深度が得られるよう、投与量を適宜減量する。











